2 Příprava (syntéza) syntetických polymerů
Syntetické polymery (nesprávně a nevhodně nazývané mnohdy jako umělé hmoty) se v zásadě připravují "řetězením" z nízkomolekulárních látek (monomerů) třemi různými chemickými postupy, tzv. polyreakcemi: polymerací, polykondenzací nebo polyadicí. Jedná se o chemické reakce, které se mnohokrát opakují, takže původně nízkomolekulární organická (případně anorganická) sloučenina monomer přechází ve vysokomolekulární látku polymer. K polyreakci může dojít tehdy, obsahuje-li monomer v molekule alespoň dvě funkční skupiny schopné reakce. Vícefunkčnost monomeru může být způsobena přítomností násobných vazeb. Díky těmto vazbám jsou monomery reaktivní a schopné vytvářet řetězovité makromolekuly.

Polymerace je reakce, při které spolu přímo reagují malé molekuly monomeru, chemici říkají, že si rozevřou dvojné vazby (z monomeru se tak stane monomerní jednotka) a propojí se do velké řetězovité molekuly polymeru (jakoby si monomerní jednotky navzájem podaly ručičky a spojily se do dlouhého řetězce), viz příklad na obr. 7. Polymery, které se takto utvoří, se nejčastěji nazývají podle monomeru přidáním předpony poly-, například polyethylen, polypropylen, polystyren, polyvinylchlorid apod.

Obr. 7: Schéma molekul ethenu a propenu a schéma radikálové polymerace polyethylenu (PE)
K zahájení polymerace je nutno rozštěpit násobnou vazbu v molekule monomeru účinkem reaktivních radikálů (R·) nebo iontů, které jsou produktem rozpadu reaktivní látky (I), tzv. iniciátoru (katalyzátoru) účinkem např. tepelné energie, UV záření apod. (I2→2R·). Tomuto ději říkáme iniciace. Iniciátorem mohou být např. peroxidy. Radikál (R·) je v chemii vysoce reaktivní částice, která má jeden nebo více nepárových elektronů. Vzniklý radikál (R·) okamžitě reaguje s molekulou monomeru a rozštěpí její násobnou vazbu, vznikne nový objemnější radikál a ten opět reaguje s další molekulou monomeru - dochází k růstu řetězce, přičemž na konci rostoucí makromolekuly se stále obnovuje volný elektron (viz obr. 7). Tomuto růstu řetězce říkáme propagace. K ukončení růstu řetězce makromolekuly dojde například spojením dvou radikálů a o tomto ději hovoříme jako o terminaci. Schéma polymerace polyethylenu (PE) je znázorněno na obr. 7. Typický řetězec polyethylenu může obsahovat řekněme 20 000 opakujících se strukturních jednotek, které vyjadřují nejmenší uskupení pravidelně opakujících se atomů v řetězci makromolekuly, resp. 10 000 monomerních (stavebních) jednotek (viz obr. 8) a má pak molární hmotnost 280 000 g/mol. Když se jeden z atomů vodíku ethenu (etylenu) nahradí methylovou skupinou -CH3 (viz obr. 7), vznikne propen (propylen) a jeho polymerací polypropylen, pokud je nahrazen atomem chloru, vznikne polymerací polyvinylchlorid, v případě náhrady benzenovým kruhem, vznikne polymerací polystyren apod. (viz obr. 9). Molekuly se běžně znázorňují plošnými vzorci (tak jak je tomu např. na obr. 9), ve skutečnosti jsou to však prostorové útvary (vazby vycházejí z atomů vždy v přesně daných úhlech).
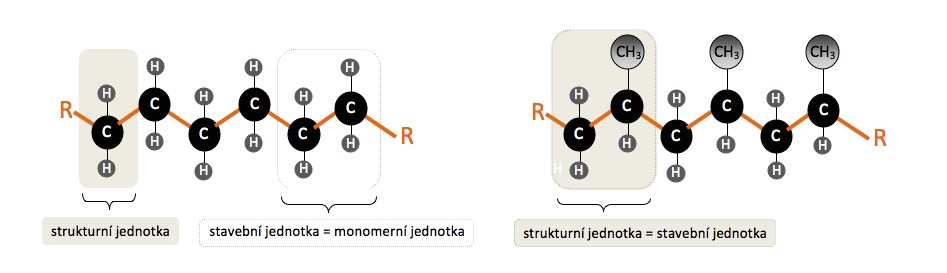
Obr. 8: Schéma makromolekulárního řetězce polyethylenu (vlevo) a polypropylenu (vpravo)
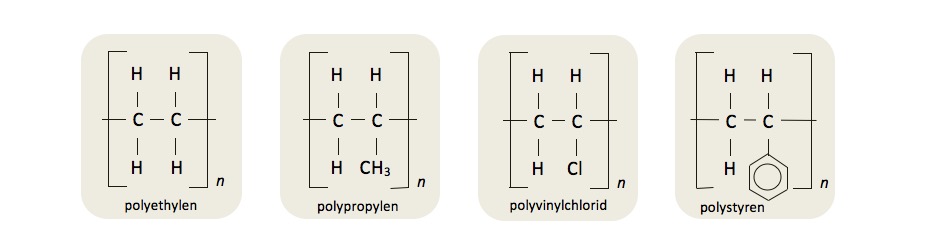
Obr. 9: Chemické vzorce polymerů: PE, PP, PVC a PS
Pro polymeraci je typické, že tvorby makromolekulárního řetězce se účastní celá molekula monomeru a nevzniká tak vedlejší produkt. Druhá cesta k polymerům se jmenuje polykondenzace. Při této stupňovité reakci se rovněž spojují molekuly monomerů do dlouhých řetězců, ale při každém připojení další monomerní jednotky se odštěpí vedlejší produkt, např. jedna molekula vody (viz příklad polykondenzace fenolu a formaldehydu na obr. 10) nebo chlorovodík či amoniak (čpavek). Výsledný polymer se tedy svým chemickým složením liší od výchozích sloučenin (na rozdíl od polymerace). Rychlost polykondenzace je oproti polymeraci, která může trvat zlomky sekund, podstatně menší. Reakci je možné v libovolném stádiu přerušit a opět v ní pokračovat například až při zpracování materiálu na finální výrobek. Takto připravené polymery dostávají obvykle jména podle typických chemických skupin, například polyformaldehydy, polyamidy, polyimidy, polyestery apod.
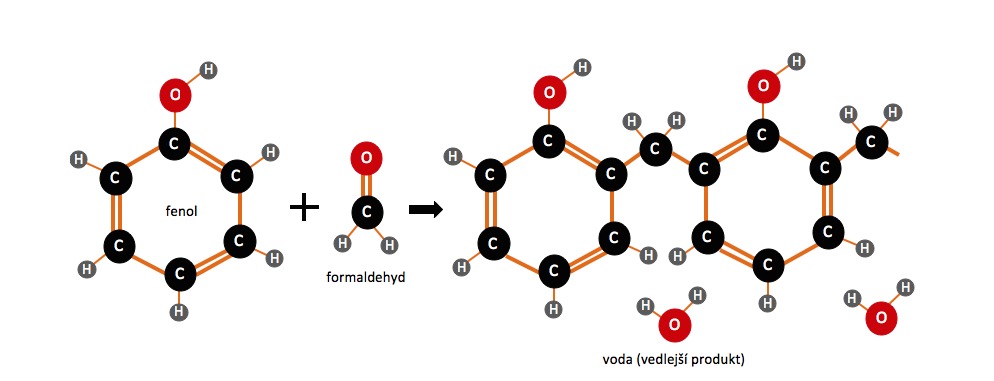
Obr. 10: Schéma přípravy fenol-formaldehydu (PF) polykondenzací
Poslední polyreakcí, při níž vznikají polymery, je polyadice (viz obr. 11). Při této stupňovité reakci reagují spolu dva odlišné druhy monomerů obsahující v molekule reaktivní atomové skupiny. Nevzniká přitom žádný štěpný produkt, ale vodíkový atom se přesouvá z jedné reaktivní skupiny na jinou, čímž probíhá slučování (adice). Polyadicí vznikají např. polyuretany a epoxidové pryskyřice.

Obr. 11: Schéma přípravy polyuretanu (PUR) polyadicí (poznámka: R=polyether nebo polyester)
Makromolekuly polymeru mohou vznikat z jednoho druhu monomeru a výsledný produkt pak nazýváme homopolymer nebo se polyreakce účastní dva či více monomerů a v takovém případě hovoříme o kopolymeru (viz obr. 12 a obr. 13). Kopolymerace má v technické praxi značný význam, protože umožňuje upravovat fyzikální vlastnosti polymeru žádoucím směrem (vlastnosti závisí na poměru monomerů a na jejich uspořádání). Typickým příkladem může být např. kopolymer polypropylenu, který je připravován polymerací ethenu a propenu za účelem získání materiálu se zvýšenou rázovou houževnatostí i za bodu mrazu (typickou pro polyethylen). Běžný polyethylen při ochlazování křehne okolo teploty cca. -120 °C (do té doby je houževnatý v širokém rozmezí teplot), zatímco polypropylen křehne již při teplotě cca. -15 °C. Kopolymer polypropylenu (tvořený monomery ethenu a propenu) bude mít lepší rázovou houževnatost za bodu mrazu než polypropylen a současně lepší pevnostní charakteristiky než jinak houževnatý polyethylen. Obdobného efektu lze docílit nejen kopolymerací, ale také přípravou polymerních směsí (např. PE/PP). Mezi další příklady kopolymerů lze uvést: ABS, SAN, PS-HI, EPDM apod. (význam jednotlivých symbolů je uveden v přehledu značení polymerů).
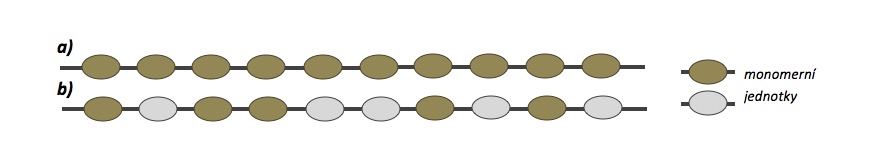
Obr. 12: Schéma řetězce makromolekuly homopolymeru (a), kopolymeru (b)
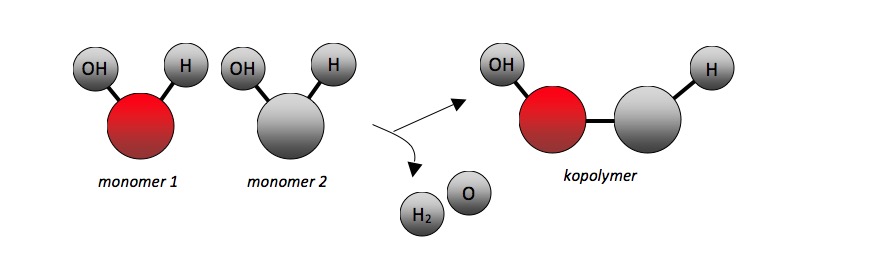
Obr. 13: Schéma vzniku kopolymeru polykondenzací (za vzniku vedlejšího produktu)
