Stavba hmoty
Co se v této kapitole dozvíte?
- Základní pojmy z historie představ o atomu.
- Bohrův model atomu, vlastnosti elementárních částic – opakování.
- Kvantová čísla – opakování.
- Vazby mezi atomy – opakování.
Základní představy a znalosti o stavbě hmoty si děti osvojují již od základní školy a na střední škole je rozvíjejí v předmětech jako je fyzika a chemie. Proto lze pokládat tuto kapitolu spíše za opakovací.
2.1 Historie představ o atomu
- Ve starém Řecku v 5. století př. n. l. přišel filozof Démokritos s teorií, že hmotu nelze dělit do nekonečna, protože na nejnižší úrovni existují dále nedělitelné částice, které označil slovem „atomos“. Podle této teorie je veškerá hmota složena z různě uspořádaných atomů různého druhu, které jsou nedělitelné, přičemž je nelze vytvářet ani ničit.
- Na počátku 19. století sestavil vědeckou formu atomové teorie John Dalton. Podle něj se každý chemický prvek skládá ze stejných atomů zvláštního typu, které nelze měnit ani ničit, ale lze je skládat do složitějších struktur (sloučenin).
- Teorii o nedělitelnosti atomu vyvrátil v roce 1897 sir Joseph John Thomson, který při studiu katodového záření objevil elektron. Na základě toho vytvořil tzv. Thomsonův model atomu, nazývaný též „pudinkový model“. Předpokládal, že atom je tvořen rovnoměrně rozloženou kladně nabitou hmotou, ve které jsou náhodně rozptýleny záporně nabité elektrony (jako rozinky v pudinku), viz obr. 2.1.
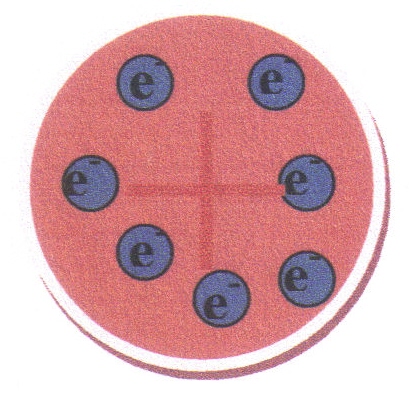
Obr. 2.1: Znázornění Thomsonova (pudinkového) modelu atomu
- V roce 1911 formuloval Ernest Rutherford planetární model atomu. Podle něj je hmotnost atomu soustředěna v jádře, které je malé vzhledem k atomu a má kladný náboj. Kolem jádra obíhají záporné elektrony (jako planety kolem Slunce). Tato představa byla ale v rozporu s klasickou elektrodynamikou, podle které by elektron obíhající kolem jádra vyzařováním elektromagnetické energie postupně ztrácel svou energii, až by spadl na jádro, čímž by atom přestal existovat. Tento rozpor byl vyřešen s příchodem Planckovy kvantové teorie, podle které se energie částic mění po určitých kvantech, nikoli spojitě (viz též kapitola 3.3.1). Toho využil Niels Bohr (viz obr. 2.2) pro svůj model atomu, který se dodnes využívá pro základní představu o atomu.

Obr. 2.2: Niels Bohr
2.2 Bohrův model atomu
- Atom se skládá z jádra, ve kterém jsou protony s kladným elektrickým nábojem a neutrony bez elektrického náboje, a z obalu, ve kterém jsou záporné elektrony. Atom je elektricky neutrální.
- Elektrony obíhají kolem jádra jen na dovolených dráhách. Mezilehlé dráhy nejsou možné a vyzařování energie není spojité. Elektrony vyzařují energii jen při přechodu elektronu z dráhy s vyšší energií na dráhu s nižší energií, při opačném přechodu elektrony energii přijímají. Elektrony se mohou pohybovat pouze po drahách, na kterých je jejich moment hybnosti roven celočíselnému násobku Planckovy konstanty (Planckova konstanta h = 6,626 . 10-34 Js).
- Bohrovy postuláty:
- Elektron se může kolem jádra pohybovat pouze po určitých drahách (kružnicích) stanovených kvantovými podmínkami. Po těchto (kvantových) drahách se pohybuje bez vyzařování energie (beze ztráty). Každé takové dráze odpovídá určitá energetická úroveň neboli hladina. To znamená, že na každé přípustné dráze má elektron určitou hodnotu celkové energie.
- Nechť jsou En, Ek dvě energetické úrovně, kde n > k a n, k = 1, 2, 3, ...(En má větší poloměr dráhy). Elektron může přeskočit z dráhy k na dráhu n, pokud přijme energii En – Ek. Obráceně při přechodu z hladiny En na hladinu Ek stejnou energii opět vyzáří ve formě elektromagnetického záření (fotonu). Pro frekvenci fotonu f platí vztah En – Ek= h f.
- Bohrův model byl zobecněn Sommerfeldem, který předpokládal pohyb elektronů po určitých drahách nejen kruhového, nýbrž i eliptického tvaru.
- Bohrův model atomu vodíku je zobrazen na obr. 2.3.
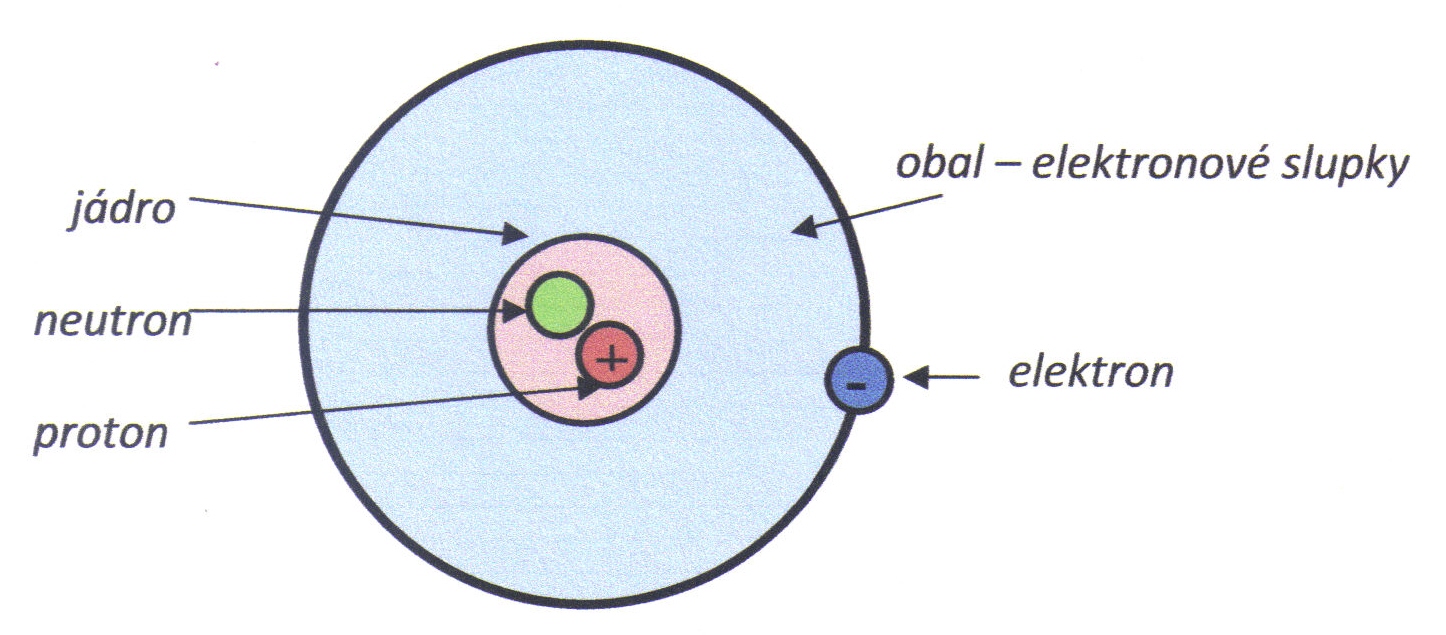
Obr. 2.3: Schéma atomu vodíku
- Proton má kladný elektrický náboj o velikosti 1,602 . 10-19 C a jeho hmotnost je 1,672 . 10-27 kg.
- Neutron nemá žádný elektrický náboj, jeho hmotnost je 1,674 . 10-27 kg.
- Protony a neutrony dohromady se označují jako nukleony. Nukleony jsou v jádře drženy silnými jadernými silami krátkého dosahu.
- Elektron má záporný elektrický náboj o velikosti 1,602 . 10-19 C, jeho hmotnost je 9,109 . 10-31 kg.
- Valenční elektron je elektron vnější slupky atomu, je schopen vytvářet chemické vazby a též je schopen vést elektrický proud. Počet valenčních elektronů určuje mocenství prvku.
- Hmotnost jádra není dána součtem hmotností všech protonů a neutronů, ale je menší o tzv. hmotnostní defekt.
- Protonové číslo Z určuje počet protonů v jádře (v základním elektricky neutrálním atomu je stejný počet protonů jako počet elektronů). Zapisuje se obvykle vlevo dole před značkou atomu, např. 6C. Též určuje pořadí prvku v periodické soustavě prvků, např. uhlík má protonové číslo Z = 6 (v jádře je 6 protonů) a je šestým prvkem v periodické soustavě prvků. Periodická soustava prvků je uvedena jako obr. 2.4.
- Nukleonové číslo A určuje počet nukleonů (protonů a neutronů dohromady) v jádře. Zapisuje se vlevo nahoru před značkou atomu, např. 12C.
- Atomy téhož prvku, které mají různý počet neutronů (a tedy různé nukleonové číslo) a přitom shodné protonové číslo, se nazývají izotopy, např. 11H (vodík), 21H (deuterium), 31H (tritium).
- Pokud se z atomového obalu oddělí jeden nebo více elektronů, z atomu vzniká kladný iont - kationt. Pokud atom získá navíc jeden nebo více elektronů, vzniká z něj záporný iont - aniont.
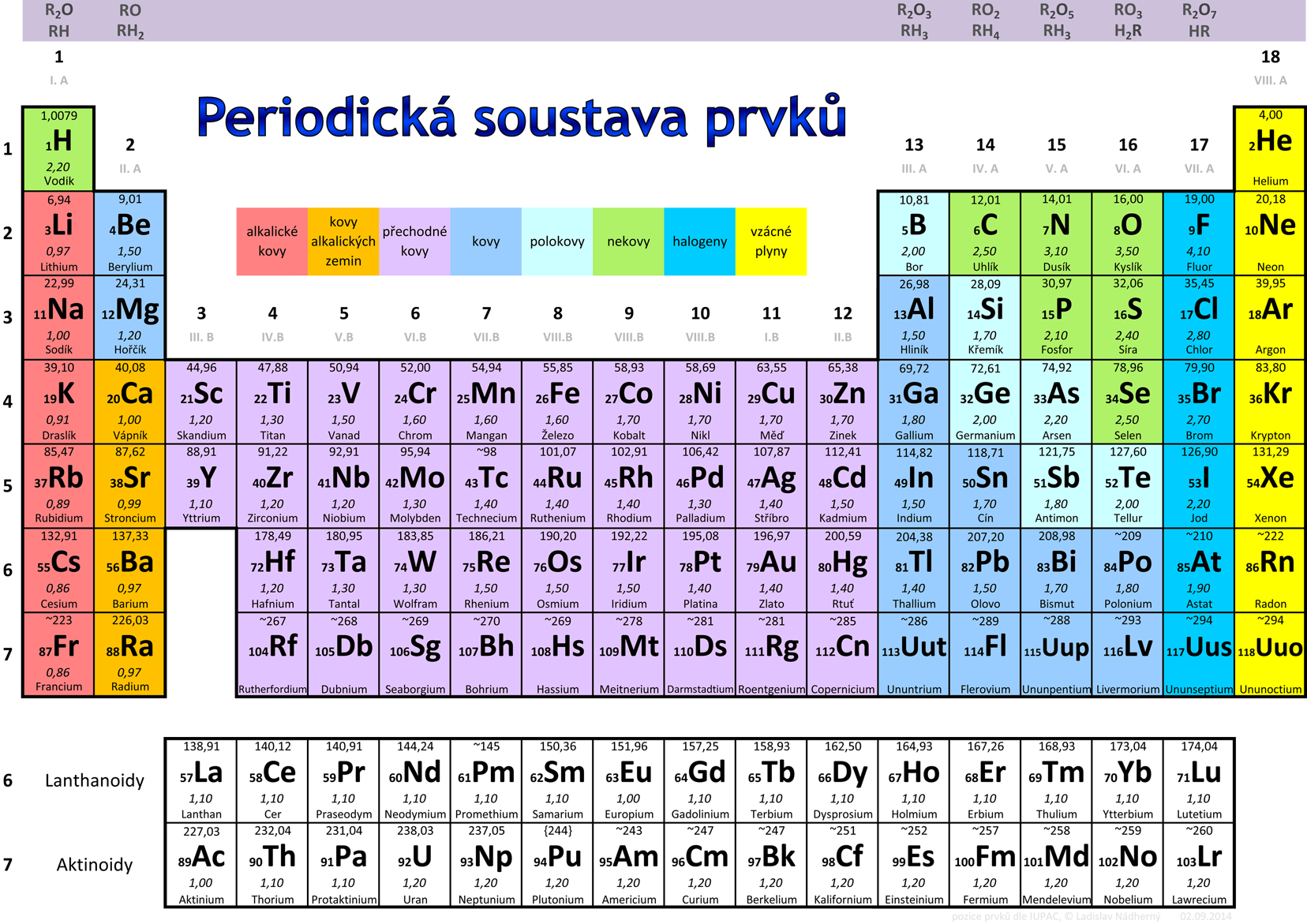
Obr. 2.4: Periodická soustava prvků
2.3 Kvantová čísla
Elektrony v atomovém obalu vykonávají dva druhy pohybu:
- a) kolem jádra po určitých orbitalech,
- b) kolem své osy.
Pohyb každého elektronu popisují kvantová čísla.
-
Hlavní kvantové číslo - n
Podle Bohra se elektron pohybuje po uzavřené dráze. Podle současných představ tvoří obal atomu elektronové slupky, což jsou vrstvy vymezující prostor, ve kterém se s určitou pravděpodobností elektron vyskytuje. Elektrony zaplňují slupky postupně, není tedy možné, aby byly obsazeny např. slupky 1, 2 a 4 a přitom nebyla obsazena slupka 3, ale nejprve se zaplní slupky 1, 2, 3 atd. Tyto slupky popisuje hlavní kvantové číslo. Toto číslo může nabývat hodnot celých čísel od 1 do 7. Slupky se označují písmeny K, L, M, N, O, P, Q. Hlavní kvantové číslo tedy udává počet kvant energie, které mají elektrony. Závisí na vzdálenosti elektronů od jádra. -
Vedlejší kvantové číslo - l
Vedlejší kvantové číslo popisuje tvar orbitalu a může nabývat hodnot celých čísel od 0 do (n -1). Podle hodnoty vedlejšího kvantového čísla se určuje vnější tvar orbitalu, ve kterém se elektrony nacházejí: l = 0 (orbital s), l = 1 (orbital p), l = 2 (orbital d), l = 3 (orbital f). -
Magnetické kvantové číslo - m
Magnetické kvantové číslo souvisí s rozložením drah elektronů (orbitalů) v prostoru. Může nabývat hodnot celých čísel od –l do +l včetně nuly. -
Spinové kvantové číslo - s
Spinové číslo souvisí se spinem elektronu, tedy s jeho rotací kolem vlastní osy. Může nabývat pouze dvou hodnot, a to + ½, - ½.
Použitím příslušných hodnot kvantových čísel je možné vyjádřit elektronové konfigurace základního stavu atomů periodické soustavy prvků.
2.4 Pauliho vylučovací princip
V témže atomu se nemohou vyskytovat dva elektrony, jejichž všechna kvantová čísla by byla shodná, musí se lišit alespoň v jednom kvantovém čísle.
Každý orbital charakterizovaný třemi kvantovými čísly může být obsazen maximálně dvěma elektrony, lišícími se spinem. To znamená, že po jedné dráze se mohou pohybovat nejvýše dva elektrony.
(Wolfgang Pauli byl rakouský fyzik, laureát Nobelovy ceny za fyziku z roku 1945. Objevil elektronový spin a neutrino, formuloval vylučovací princip, vypracoval spolu s Heisenbergem teorii kvantové elektrodynamiky a teorii elementárních částic.)
2.5 Vazby mezi atomy
Jednotlivé samostatné atomy se vyskytují pouze vzácně, atomy se sdružují vazbami do molekul. Schopnost atomů tvořit molekuly závisí na skladbě elektronových slupek.
Molekuly se vytvářejí:
- a) z atomů jednoho prvku - např. H2, Cl2,
- b) ze dvou a více prvků - např. H2O, HCl.
2.5.1 Kovová vazba
Kovová vazba je specifický typ chemické vazby mezi atomy kovů. Podle současných představ jsou krystaly kovů tvořené kationty, které obsazují uzlové body krystalové mřížky, a v prostoru mezi nimi se neuspořádaně pohybují odštěpené valenční elektrony, viz obr. 2.5. Volné elektrony se označují pro svou velkou pohyblivost jako elektronový plyn. Kovový krystal lze pokládat za soustavu kladných iontů kovu vázaných s volnými elektrony.
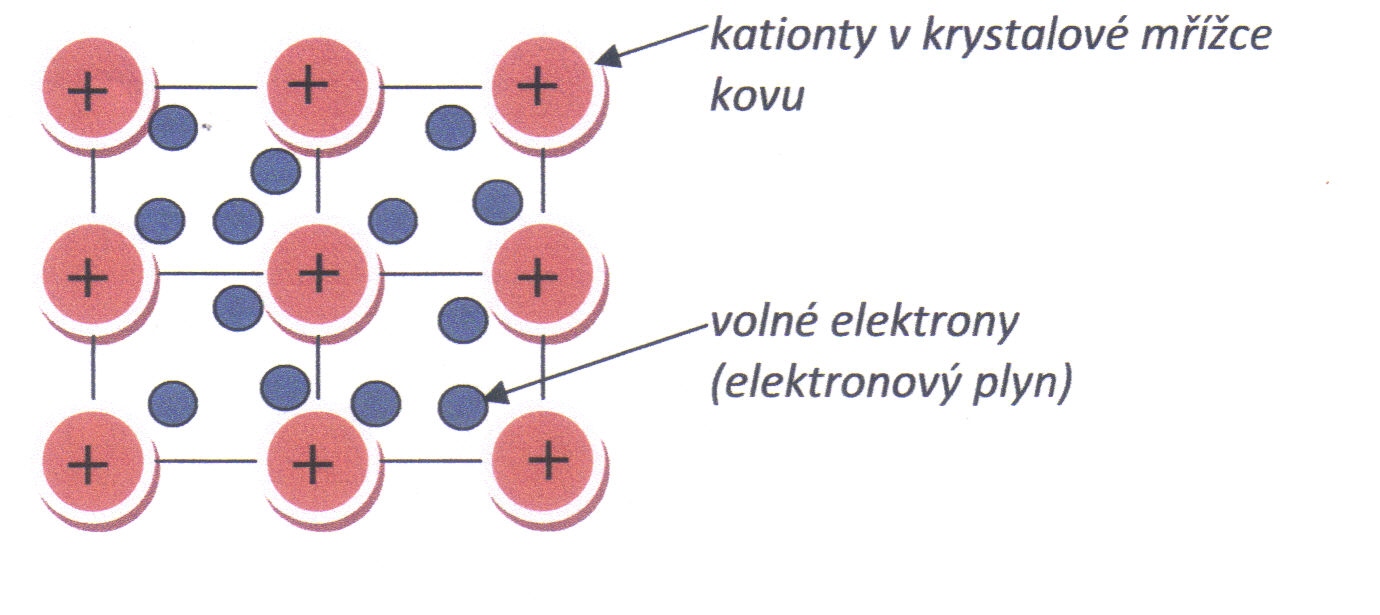
Obr. 2.5: Kovová vazba
2.5.2 Kovalentní vazba
Kovalentní vazba je nejběžnější chemickou vazbou. Nalézá se mezi sloučenými atomy se stejnou či mírně odlišnou elektronegativitou. Jeden nebo více párů valenčních elektronů je sdíleno dvěma prvky. Tato vazba je např. mezi dvěma atomy chloru (Cl2), nebo vodíku (H2), kde je elektronegativita atomů stejná. U chlorovodíku (HCl) nebo vody (H2O) je elektronegativita mírně odlišná. Kovalentní vazba může být jednoduchá, dvojná, nebo trojná. Na obr. 2.6 je zobrazena kovalentní vazba u chlorovodíku.
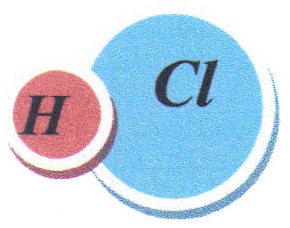
Obr. 2.6: Kovalentní vazba u chlorovodíku
2.5.3 Iontová vazba
Iontová vazba vzniká, pokud je rozdíl elektronegativit sloučených atomů vyšší. Váží se spolu kladné a záporné ionty (valenční elektron jednoho atomu přejde do druhého atomu), nevyskytují se zde volné elektrony. Iontová vazba tedy znamená, že sloučené atomy jsou vázány pouze na základě silového působení opačně nabitých částic (kladných kationtů a záporných aniontů). Příkladem sloučenin s iontovou vazbou je chlorid sodný NaCl, ten má krystalovou strukturu s pravidelně se střídajícími kationty sodnými Na+ a chloridovými anionty Cl-. Princip iontové vazby je na obr. 2.7, kde jsou kladné ionty zobrazeny červeně a záporné ionty modře.
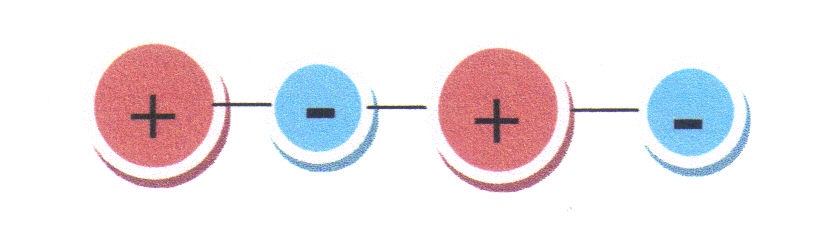
Obr. 2.7: Princip iontové vazby
2.5.4 Van der Waalsovy síly
Van der Waalsovy síly jsou slabé vazebné interakce elektroneutrálních atomů nebo molekul, interakce mezi dvěma permanentními dipóly, nebo mezi permanentním a indukovaným dipólem. S touto vazbou se setkáváme u dielektrik a izolantů (např. slída), kde jsou buď permanentní dipóly, nebo se při elektrické polarizaci vytvářejí dipóly indukované. Princip této vazby je na obr. 2.8.
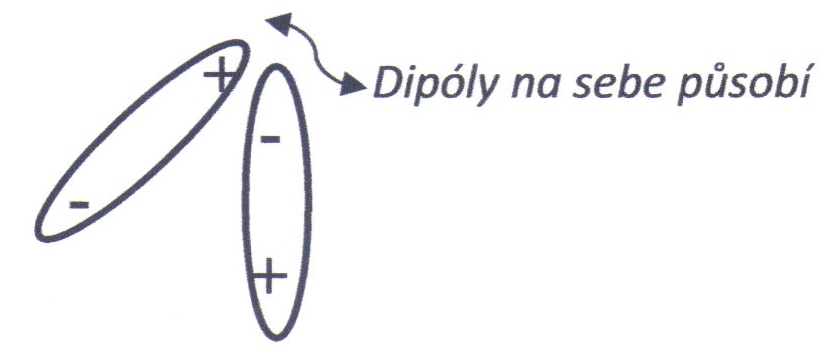
Obr. 2.8: Princip Van der Waalsovy vazby
2.6 Kontrolní otázky
Zdroje:
[1] Atom [online]. Wikipedie. [vid. 2. 4. 2016]. Dostupné z: https://cs.wikipedia.org/wiki/Atom#Historick.C3.BD_v.C3.BDvoj_atomov.C3.A9_teorie.
[2] DRÁPALA Jaromír, KURSA Miroslav. Elektrotechnické materiály, učební texty [online]. Ostrava: VŠB - Technická univerzita Ostrava 2012. ISBN 978-80-248-2570-0. [vid. 2. 4. 2016]. Dostupné z: http://www.person.vsb.cz/archivcd/FMMI/ETMAT/Elektrotechnicke%20materialy.pdf.
[3] Kvantová čísla [online]. Artemis.osu. [vid. 1. 3. 2016]. Dostupné z: http://artemis.osu.cz/mmfyz/am/am_2_2.htm.
[4] Osobnosti jaderné fyziky [online]. ČEZ. [vid. 25. 2. 2016]. Dostupné z: http://www.cez.cz/edee/content/microsites/nuklearni/k43.htm.
Média:
Obr. 2.1 Znázornění Thomsonova (pudinkového) modelu atomu: archiv autorky
Obr. 2.2 Niels Bohr: Niels Bohr [Fotografie]. In: Osobnosti jaderné fyziky [online]. ČEZ. [vid. 25. 2. 2016]. Dostupné z: http://www.cez.cz/edee/content/microsites/nuklearni/k43.htm
Obr. 2.3 Schéma atomu vodíku: archiv autorky
Obr. 2.4 Periodická soustava prvků Periodická soustava prvků [obrázek]. VŠCHT [online]. [vid. 25. 2. 2016]. Dostupné z: http://web.vscht.cz/~nadhernl/psp.html
Obr. 2.5 Kovová vazba: archiv autorky
Obr. 2.6 Kovalentní vazba u chlorovodíku: archiv autorky
Obr. 2.7 Princip iontové vazby: archiv autorky
Obr. 2.8 Princip Van der Waalsovy vazby: archiv autorky