Atomová fyzika je část fyziky, která se zabývá chováním elektronů v obalech atomů, přičemž atomové jádro je pouze kladně nabitý bodový náboj, který se nemění.
1. Vývoj názorů na stavbu atomu
Všechny látky se skládají z částic (atomů a molekul). Tyto částice se v látce neustále a neuspořádaně pohybují.
První zmínka o atomech pochází ze Starého Řecka. Staří Řekové považovali atom za nejmenší, dále nedělitelnou částici hmoty (atomos = nedělitelný). Za zakladatele atomové teorie je považován Demokritos.

Obr. 14 – Thomsonův model atomu
1899 - Joseph John Thomson (objevitel elektronu) si představoval atom jako kouli z kladně nabité látky, uvnitř se pohybují záporně nabité elektrony. Ty jsou také příčinou elektrických vlastností látek. Tento model se nazývá pudinkový model atomu. Později se ukázalo, že Thomsonův model vůbec neodpovídá skutečnosti.
1911 – Ernest Rutherford sestavil experiment, při kterém ostřeloval zlatou fólii jádry helia a zjišťoval, jak jí jádra procházejí. Zjistil, že většina jader fólií prošla, jen některé se výrazně odklonily od svého směru. Rutherford na základě experimentů formuloval nový model atomu. Jako první zjistil, že atom se skládá z kladně nabitého, malého a těžkého jádra a záporně nabitého obalu, kde krouží elektrony. Bohužel ani jeho představa nebyla zcela správná, protože kroužící elektron by neustále vyzařoval energii a přibližoval se k jádru. A tak by atomy ve velmi krátké době zanikly.
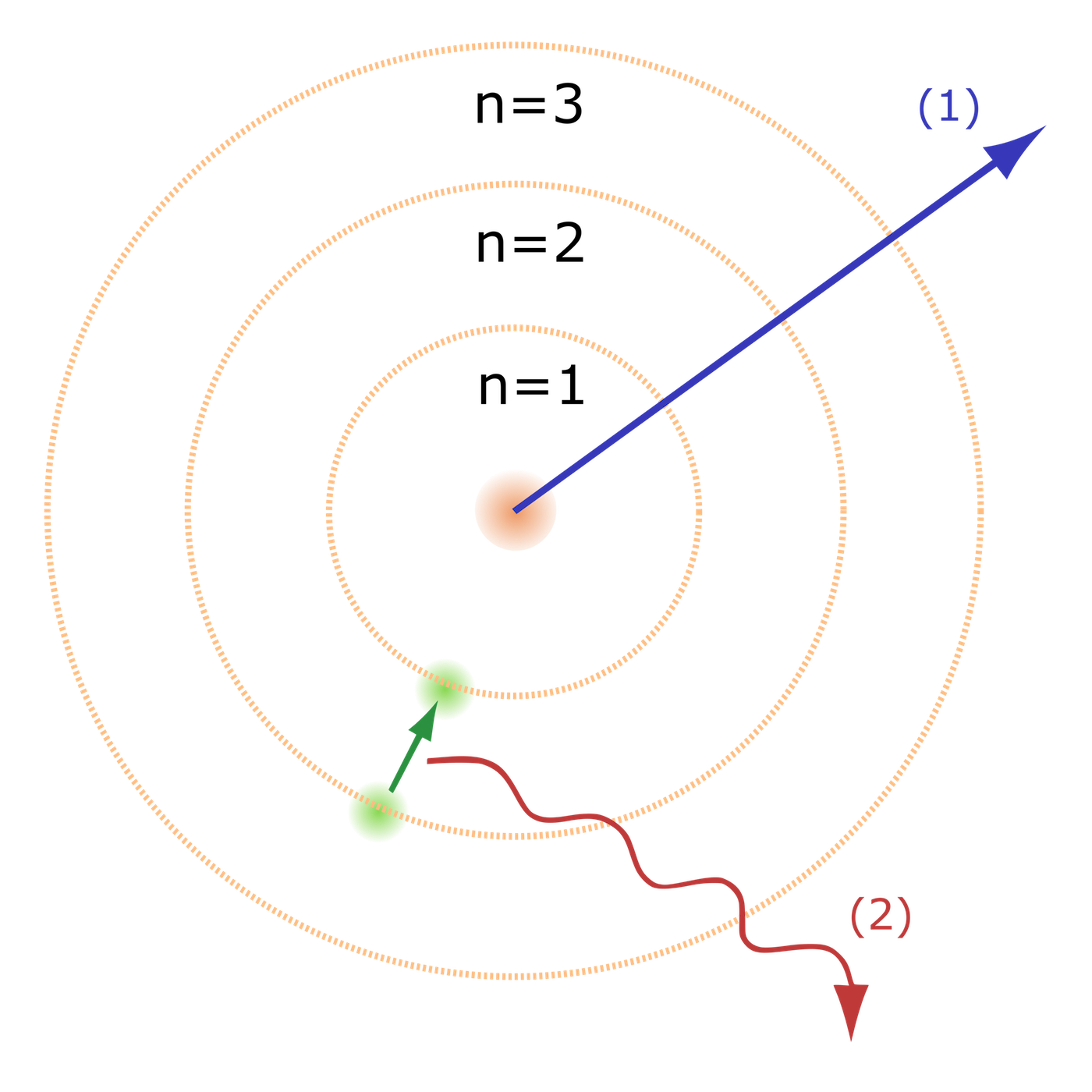
Obr. 15 – Bohrův model atomu
1913 – Niels Bohr patřil k prvním zastáncům Einsteinovy teorie relativity a kvantování energie. Popsal chování elektronů v elektronovém obalu atomu. Formuloval tři postuláty:
- elektrony obíhají kolem jádra po kružnicích
- elektron na své dráze nevyzařuje ani nepřijímá žádnou energii
- jestliže atom přijme nebo vyzáří kvantum energie, přeskočí elektron na vyšší nebo nižší energetickou hladinu
Planetární Sommerfeldův model vychází z toho, že trajektorie, po kterých se elektrony pohybují, jsou eliptické a samotné elektrony popisují kvantová čísla. Přičemž žádné dva elektrony nemohou mít všechna čtyři kvantová čísla stejná.

Obr. 16 – planetární model atomu
1925 – Erwin Schrӧdinger zjistil, že elektrony mají korpuskulárně-vlnový charakter a neobíhají kolem jádra po kružnicích, ale můžeme jen s určitou pravděpodobností vymezit prostor, ve kterém se v obalu elektron nachází. Tuto oblast nazval atomový orbital. Jeho model se nazývá kvantově mechanický.