Jaderná fyzika je část fyziky, která se zabývá strukturou a přeměnami atomového jádra.
1. Atomové jádro
Atomové jádro je centrální část atomu s průměrem řádově 10-15m. Má kladný elektrický náboj a je v něm soustředěno přes 99 % hmotnosti celého atomu. Hustota jádra je obrovská (řádově 1017 kg.m-3).
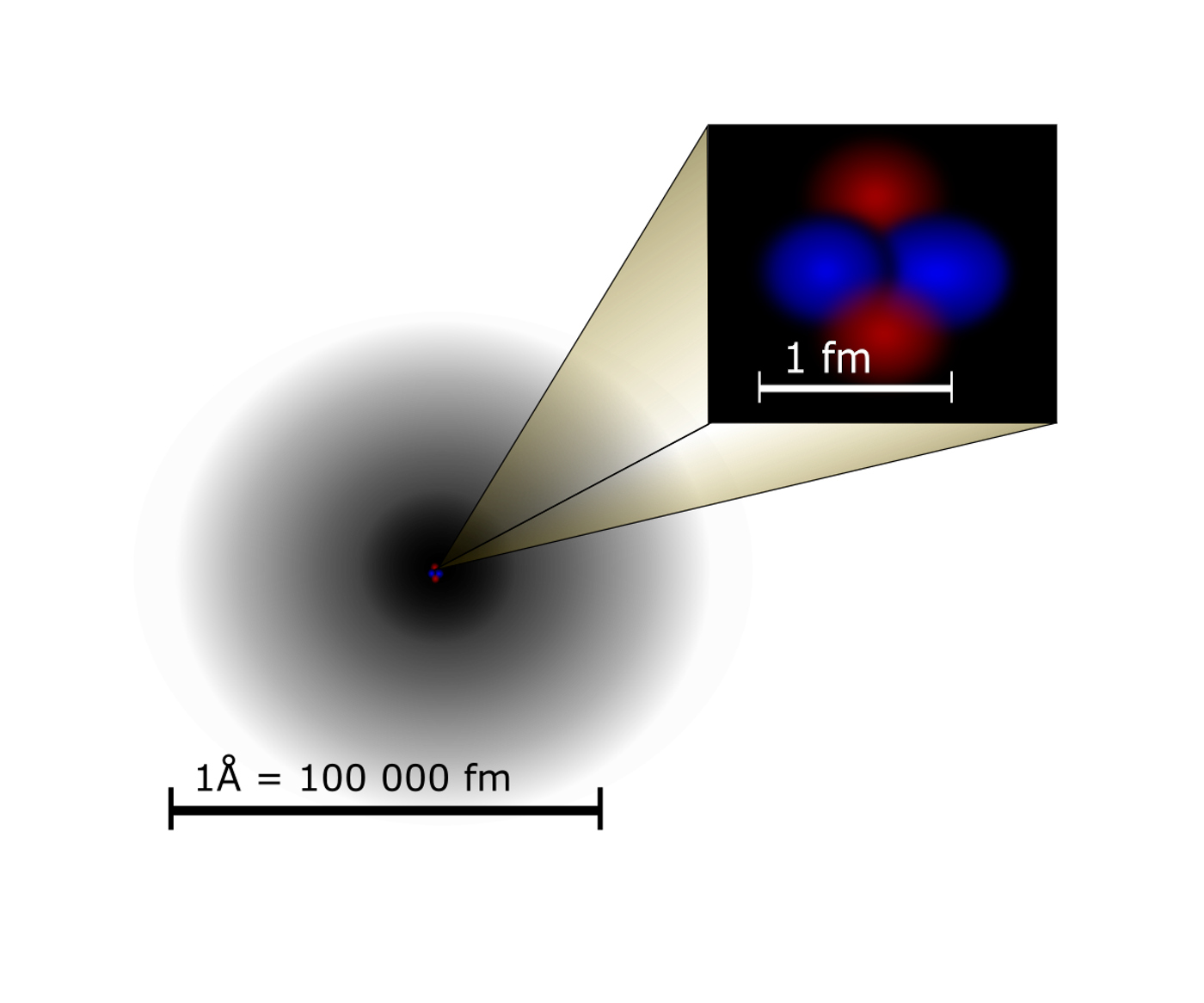
Obr. 42 – atomové jádro
1.1. Složení atomového jádra
Atomové jádro se skládá z protonů a neutronů. Tyto částice souhrnně nazýváme nukleony. Nukleony patří mezi fermiony. Protony mají kladný elektrický náboj, který je stejně veliký jako náboj elektronu, neutrony jsou bez náboje. Klidová hmotnost těchto částic je přibližně 1840 krát větší než klidová hmotnost elektronu. Základními stavebními jednotkami nukleonů jsou kvarky. Proton je tvořen dvěma kvarky typu u, které mají náboj `(2)/(3)e^-` a jedním kvarkem typu d s nábojem `(1)/(3)e^-`. Neutron je tvořen jedním kvarkem u a dvěma kvarky d.
V tabulce jsou uvedeny některé důležité vlastnosti nukleonů.
|
Částice |
Hmotnost |
náboj |
Objevitel |
|
|
kg |
mu |
C |
||
|
Proton |
1,67252.10-27 |
1,0072 |
1,602.10-19 |
Rutherford -1920 |
|
Neutron |
1,67482.10-27 |
1,0086 |
Nemá náboj |
Chadwick -1932 |
Velikosti kladného náboje jader se rovnají celočíselným násobkům náboje elektronu:
dusík `Q = 7 * e^{-} = 1,1214 * 10^-18 C`
stříbro `Q = 47 * e^{-} = 7,5294 * 10^-18 C`
Hmotnosti jader se přibližně rovnají celočíselným násobkům jádra vodíku:
dusík `m = 14,07 * m_H `
stříbro `m = 107,87 * m_H `
Musíme si však uvědomit, že atomy jednoho prvku nemusí být stejné. Všechny mají sice stejný náboj jádra, stejný elektronový obal, ale mohou se lišit svou hmotností. Důvodem je různý počet neutronů v jádrech atomů. Například atomy chloru mohou obsahovat v jádře 18 neutronů a potom hmotnost těchto jader je 35.mH nebo také 20 neutronů a jejich hmotnost je 37.mH. Přihlédneme-li k zastoupení těchto atomů v přírodě (prvních je 75,4% a druhých 24,6%), pak je hodnota uvedená v periodické tabulce 35,453 správná. Hmotnost jádra chloru je pak m=35,5.mH.
Způsob zápisu složení atomového jádra:
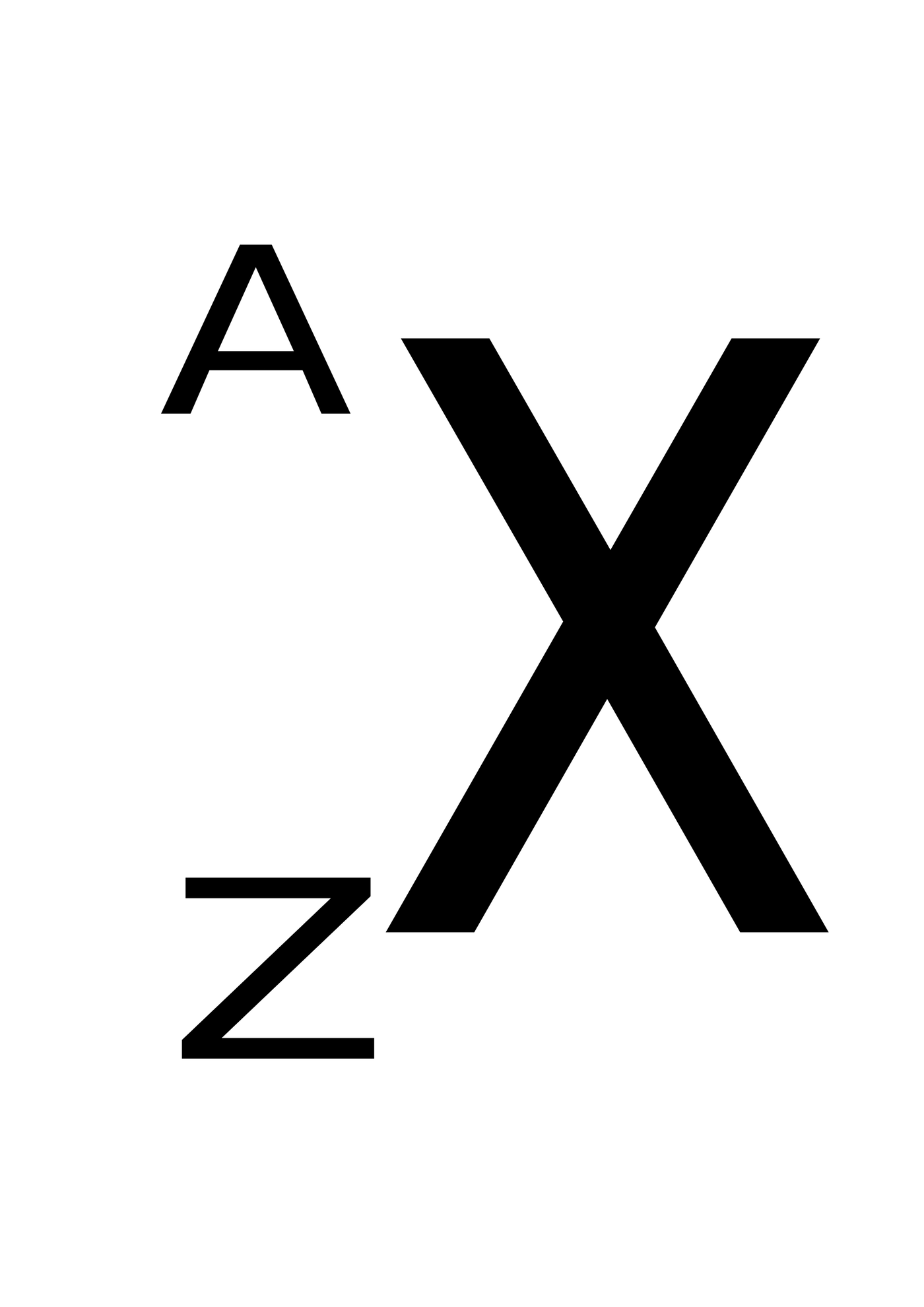
Obr. 43 – zápis složení jádra
| X | ………. | obecná značka prvku |
| Z | ………. | protonové číslo – udává počet protonů v jádře, počet elektronů v obalu a pořadí v periodické tabulce prvků |
| A | ………. | nukleonové číslo – udává počet nukleonů (protonů a neutronů) v jádře |
| N | ………. | neutronové číslo – udává počet neutronů v jádře |
Platí:
`A = Z + N `
Příklad:

Obr. 44 – zápis prvku v periodické tabulce
Atom sodíku Na má protonové číslo 11 a nukleonové číslo 23. V jádře je tedy celkem 23 nukleonů (11 protonů a 12 neutronů), v obalu atomu je 11 elektronů.
Chemicky čistý prvek se obvykle skládá z atomů s různým počtem neutronů v jádře. Jestliže je složen z atomů se stejným počtem neutronů, nazýváme ho nuklid.
Nuklidy prvků se často zobrazují do grafu Z = f(N):
Obr. 45 - graf Z=f(N)
1. Může se jádro skládat z libovolné kombinace protonů a elektronů?
2. Jaký je nejtěžší stabilní prvek?
3. Převažují stabilní nebo nestabilní jádra
1.2. Jaderné síly
Jádra jsou tvořena protony a neutrony.
1. Za předpokladu, že hmotnost protonů a neutronů je přibližně stejná (1,67.10-27kg), vypočítejte gravitační sílu, kterou na sebe v jádře působí dva nukleony.

2. Vypočítejte elektrickou sílu, kterou se odpuzují v jádře každé dva protony.

Z předchozích výpočtů plyne, že odpudivá síla je mnohem větší než gravitační přitažlivá síla mezi částicemi. Jádro tedy nemůže držet pohromadě.
Protony a neutrony v jádře musí přitahovat jiná síla, která je mnohem větší než elektrická odpudivá síla. Tato síla se nazývá jaderná síla. Mluvíme o ní také jako o silné interakci.
Tato síla
- působí jen na velmi krátké vzdálenosti (musí překonat elektrické síly, ale zároveň mimo oblast jádra musí být slabší než síla elektrická, aby nedošlo ke sloučení všech jader dohromady).
- má vlastnost nasycení, tzn. každý nukleon se může přitahovat jen s určitým počtem jiných nukleonů v bezprostřední blízkosti.
- působí bez rozdílu náboje
1.3. Vazebná energie jádra
Již víme, že jádro se skládá z protonů a neutronů. Hmotnosti těchto částic jsou poměrně přesně známy. Jestliže budeme mít jádro, které obsahuje Z protonů a N neutronů, měla by jeho hmotnost být dána součtem hmotností všech těchto částic.
`m_j = Z * m_p + N * m_n`
Hmotnostním spektrometrem bylo zjištěno, že skutečná hmotnost jader je menší než hmotnost částic, ze kterých jádro vzniklo.
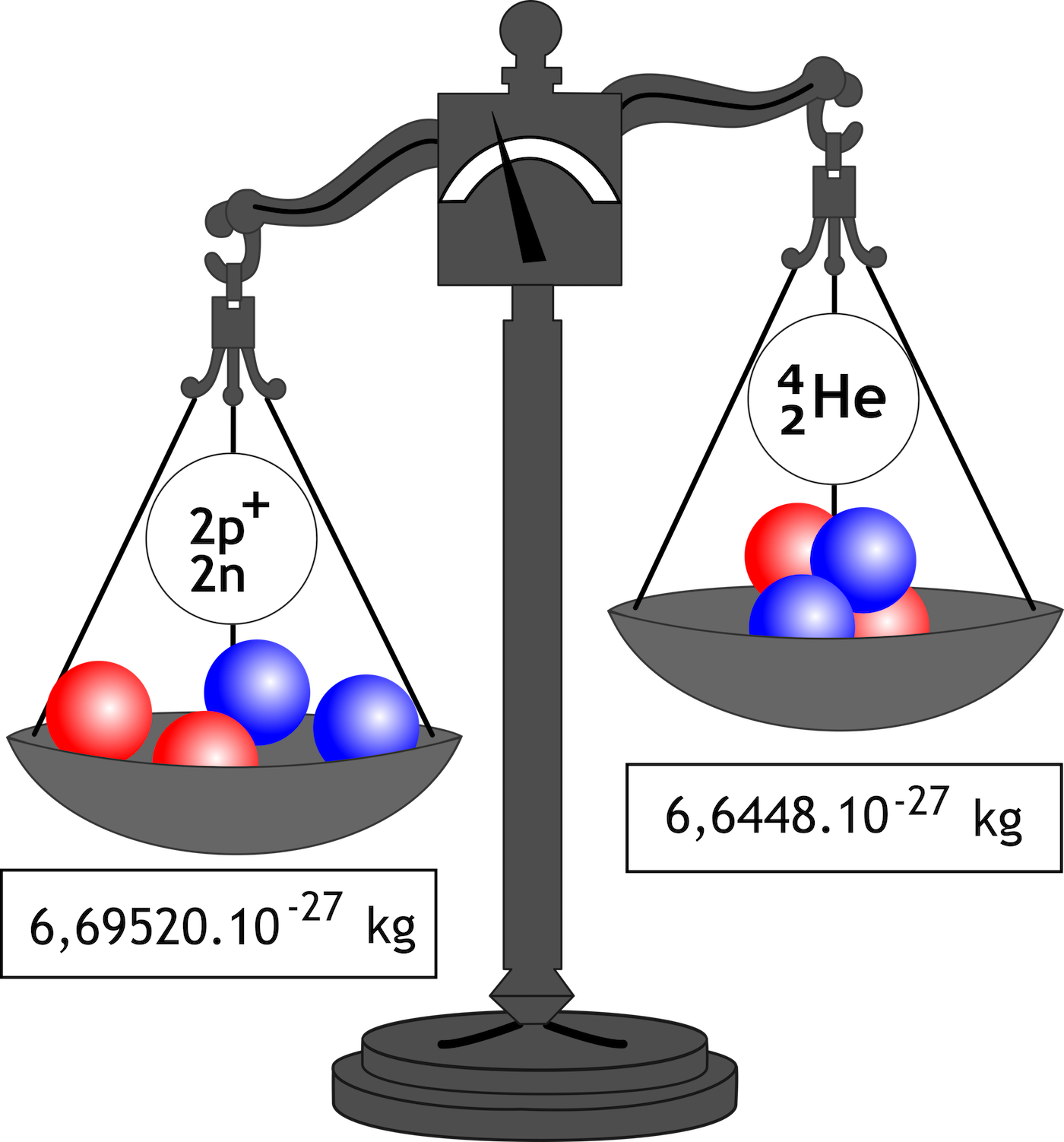
Obr. 46 – hmotnostní úbytek
Jak tuto skutečnost můžeme vysvětlit? Při vzniku jádra z volných protonů a neutronů dochází k uvolnění energie. Jádro je tedy z hlediska energie výhodnější útvar než samostatné nukleony. Ze Speciální teorie relativity již víme, že platí Einsteinův vztah mezi energií a hmotností.
`∆E = ∆m * c^2 `
Ze vztahu plyne, že pokles energie je vždy spojen s poklesem hmotnosti. Proto je skutečná hmotnost jádra menší než bychom předpokládali.
Dusík obsahuje 7 protonů a 7 neutronů v jádře, předpokládaná hmotnost jádra by měla být 2,34.10-26 kg. Skutečná hmotnost jádra je však 2,3219.10-26 kg. O kolik procent je menší skutečná hmotnost jádra?

Rozdíl skutečné a předpokládané hmotnosti jádra ∆m se nazývá hmotnostní úbytek. Lze ho vypočítat následujícím způsobem:
`∆m = Z * m_p + N * m_n - A_r * m_u `
Jestliže známe hmotnostní úbytek, můžeme spočítat vazebnou energii jádra Ej :
`E_j = ∆m * c^2 `
Vazebná energie jádra je energie, kterou bychom jádru museli dodat, aby se rozdělilo na jednotlivé nukleony. Obvykle tuto energii udáváme v joulech (J) nebo elektronvoltech (eV).
Vazebná energie jádra je i mírou stability jádra. Čím je tato energie větší, tím nesnadněji lze jádro rozdělit na jednotlivé nukleony. Vazebná energie jader se pohybuje od 2,22 MeV pro deuterium až po 1800 MeV pro těžká jádra. Porovnáme-li tyto hodnoty s vazebnou energií celého atomu (0,12 MeV) nebo vazebnou energií atomů v molekulách (pouze několik eV), vidíme, že vazebná energie jader je velká.
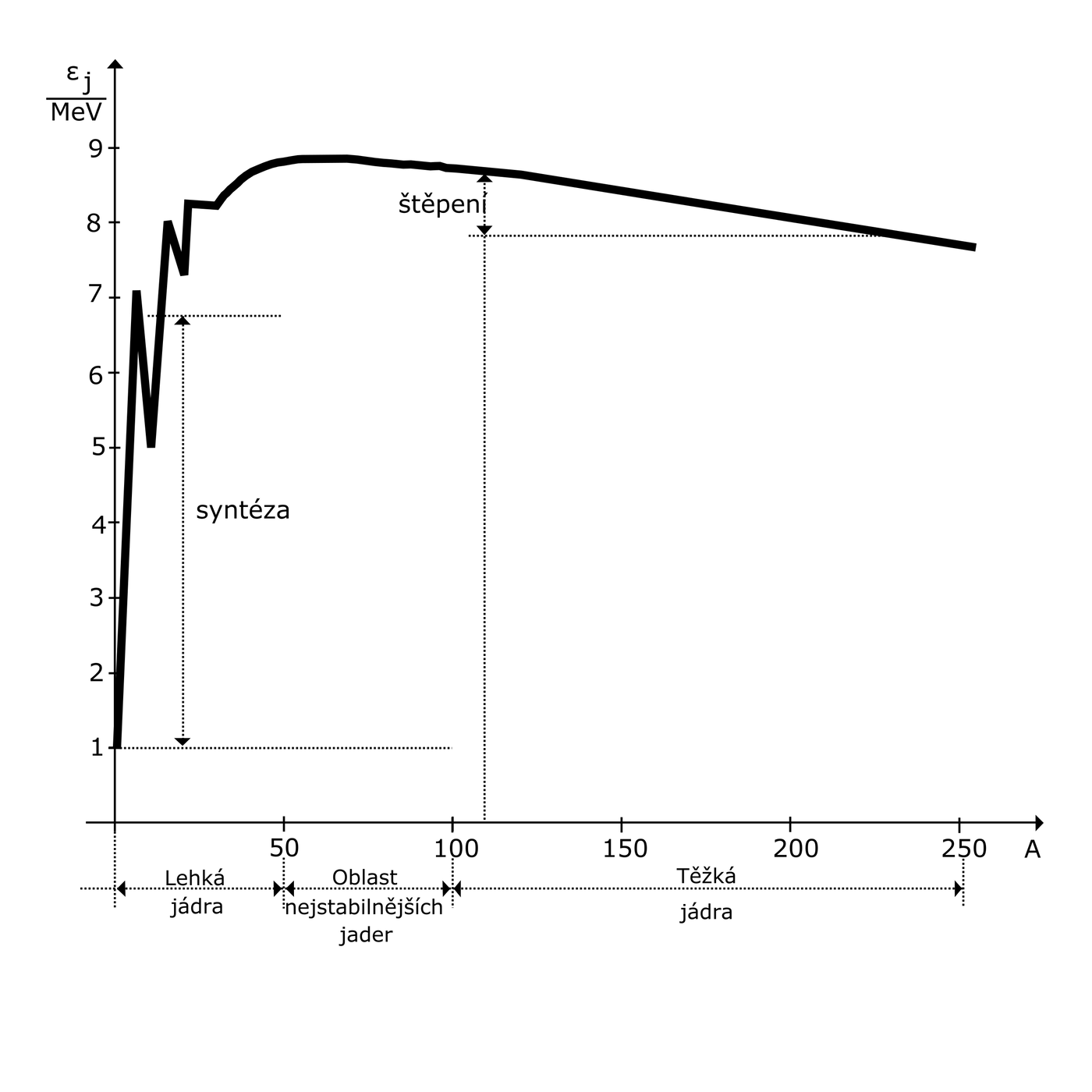
Obr. 47 – graf Ɛj=f(A)
Vazebná energie připadající na jeden nukleon potom je:
`Ɛ_j = E_j/A `
Vypočítejte hmotnostní úbytek, vazebnou energii jádra a vazebnou energii připadající na jeden nukleon pro jádro atomu Lithia.

Testové otázky
| Rozhodněte, zda je tvrzení pravdivé (ANO) nebo nepravdivé (NE): | ANO | NE |
|
A. atom se skládá z jádra a obalu |
||
|
B. protony jsou těžší než elektrony |
||
|
C. neutrony jsou v obalu atomu |
||
|
D. elektron je kladně nabitý |
||
|
E. neutron je bez náboje |
||
|
F. v jádře jsou protony a neutrony |
||
|
G. kationty vznikají odebráním elektronů z obalu |
||
|
H. atom je elektricky nabitá částice |
||
|
I. anionty jsou záporně nabité |
||
|
J. jádro je lehčí než obal |
||
|
K. jádro je mnohem menší než obal |
