Stavba elektronového obalu je složitá, protože závisí na rozložení elektronů v obalu. Toto rozložení se znázorňuje pomocí orbitalů. Nemůžeme však tvrdit, že elektron se pohybuje po orbitalu nebo se na tomto místě nachází.
Atomový orbital je oblast v okolí jádra, kde je největší pravděpodobnost nalezení elektronů. Tvar a orientaci orbitalu popisují kvantová čísla.
3.1. Kvantová čísla
Popisují velikost, tvar a orientaci atomového orbitalu.
3.1.1. Hlavní kvantové číslo n
Rozhoduje o velikosti a energii atomového orbitalu. Ze dvou stavů se stejným orbitalem a různým n, je průměrná vzdálenost elektronu od jádra větší ve stavu s větší hodnotou n přibližně n2 krát.
`n ∈ N = {1,2,3, ...} `
3.1.2. Vedlejší kvantové číslo l
Vedlejší kvantové číslo určuje tvar orbitalu, u prvků s více elektrony ovlivňuje energii elektronů. Čím větší je hodnota n, tím více hodnot může vedlejší kvantové číslo nabývat.
`l ∈ N_0 = {0,1,2,..., n-1} `
Hodnoty vedlejšího kvantového čísla bývají častěji popisovány písmenem, každému písmenu odpovídá charakteristický tvar orbitalu.
Pro l = 0 je orbital nazýván s-orbitalem:
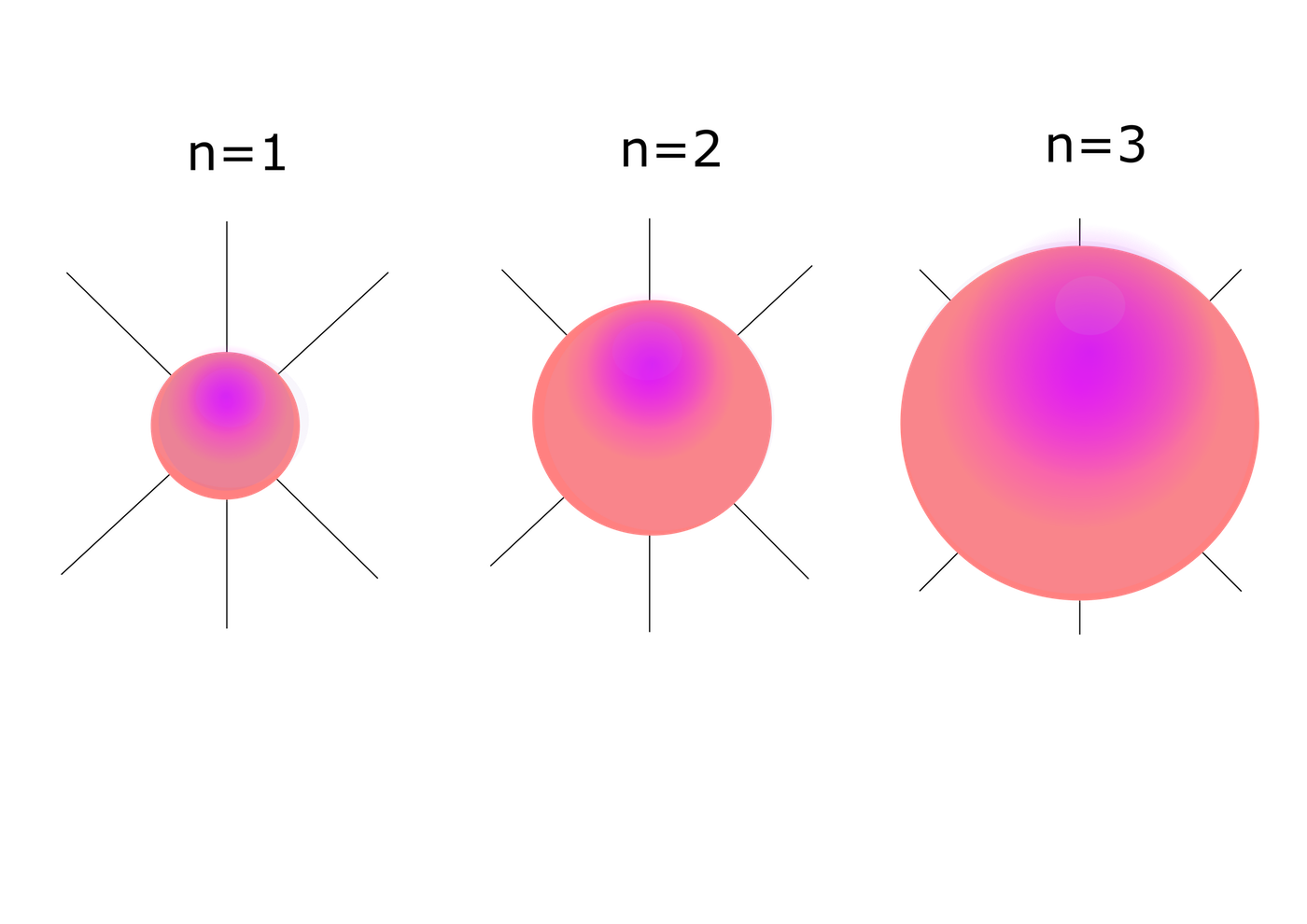
Obr. 22 – s-orbital
Pro l = 1 je orbital nazýván p-orbitalem:
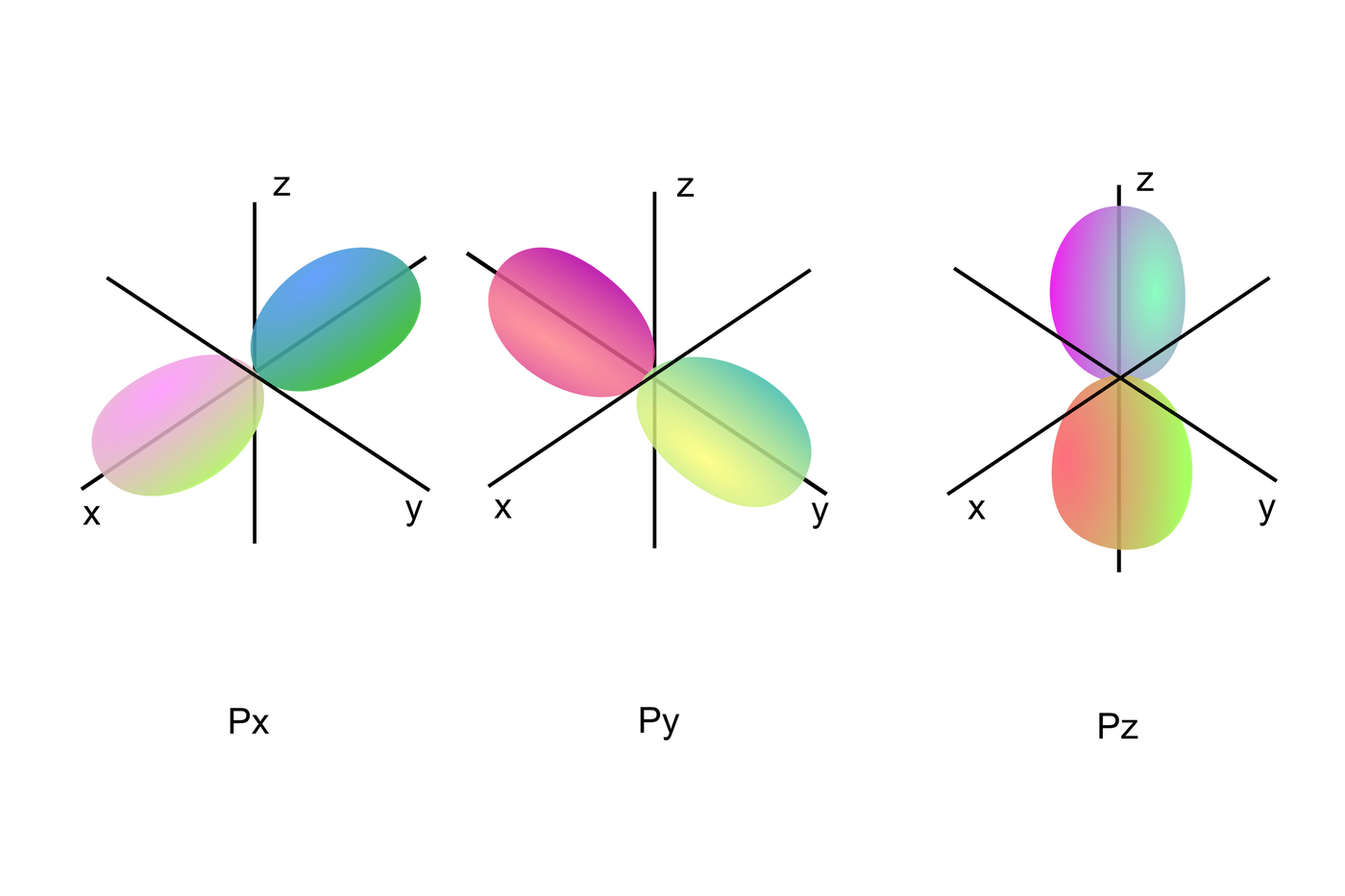
Obr. 23 – p-orbital
Pro l = 2 je orbital nazýván d-orbitalem:
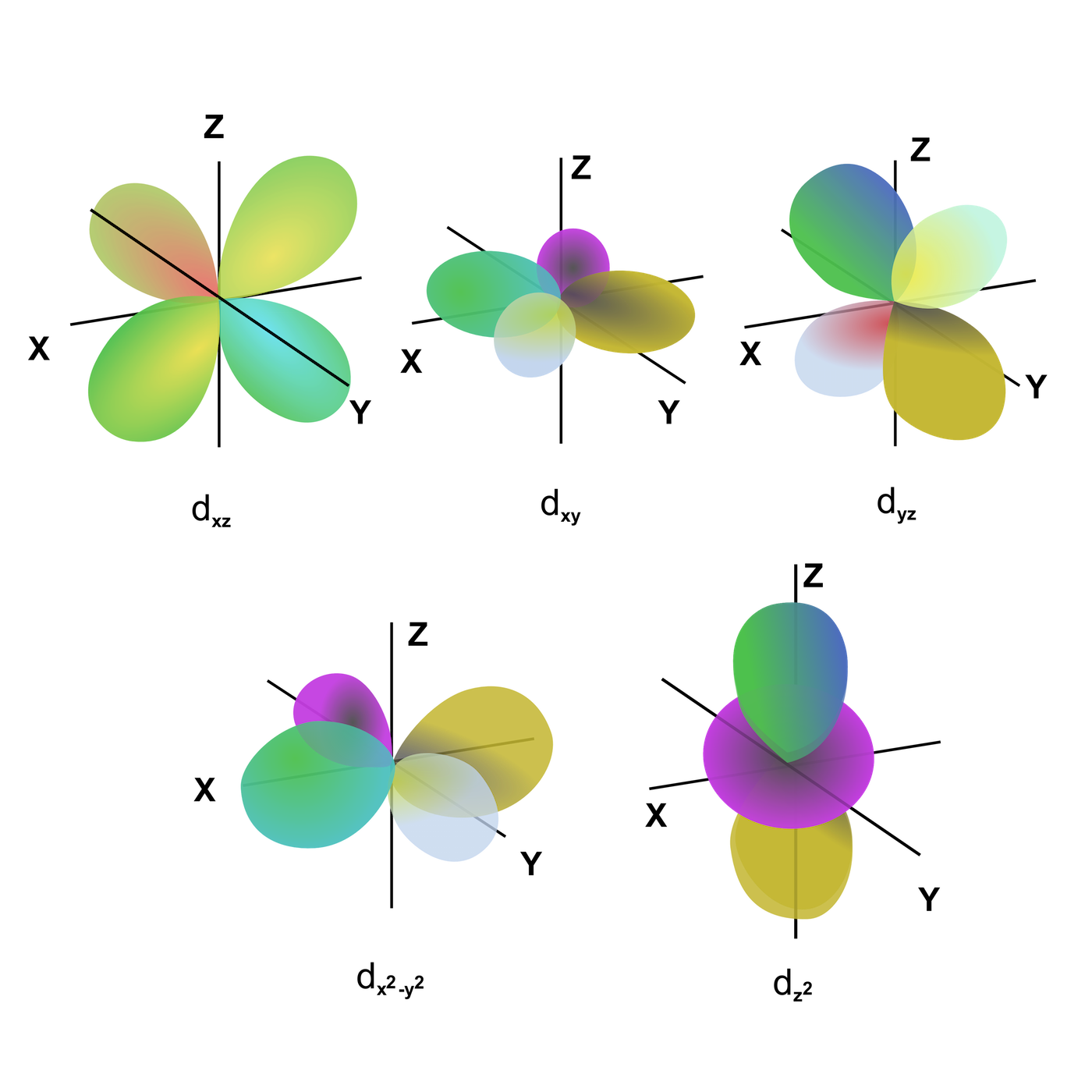
Obr. 24 – d-orbital
Pro l = 3 je orbital nazýván f-orbitalem:

Obr. 25 – f-orbital
Jestliže je orbital popsán hlavním kvantovým číslem n = 3 a vedlejším kvantovým číslem l = 1, nazveme orbital 3p.
3.1.3. Magnetické kvantové číslo m
Určuje orientaci orbitalu v prostoru. Pokud se atom nachází ve vnějším magnetickém poli, ovlivňuje magnetické číslo energii elektronu, ale v menší míře, než hlavní a vedlejší kvantové číslo.
`m ∈ Z = {-l,..., 0,..., +l} `
Počet možných hodnot čísla m (při stejném n a l) udává počet elektronů se stejnou hodnotou energie. Tomuto číslu se říká stupeň degenerace.
Například:
V orbitalu, pro který platí, že n = 2 a l = 1, může magnetické číslo nabývat hodnot -1, 0, 1. V orbitalu p jsou tedy 3 elektrony se stejnou hodnotou energie, říkáme, že je třikrát degenerovaný.
V tabulce vidíme, že orbitaly s jsou jedenkrát degenerované, orbitaly typu p třikrát degenerované, orbitaly typu d jsou pětkrát degenerované a orbital typu f je sedmkrát degenerovaný.
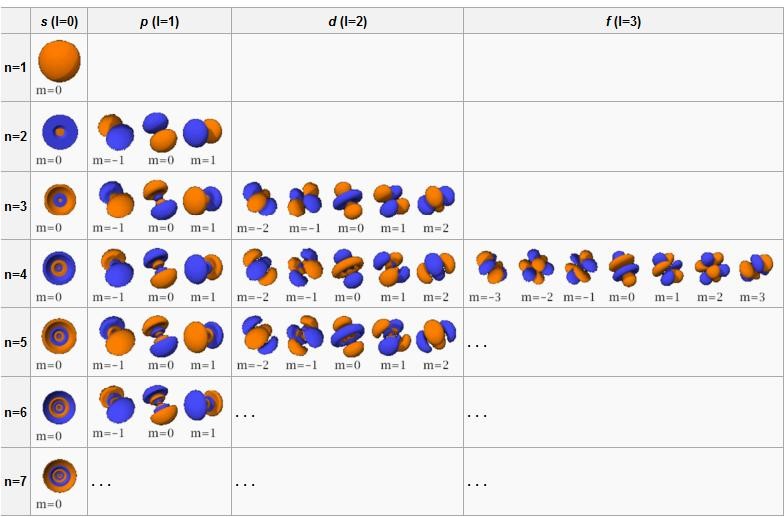
Obr. 26 – přehled orbitalů
3.1.4. Spinové kvantové číslo s (ms)
Udává hodnotu spinu elektronu a nabývá pouze dvou hodnot:
`s = {-1/2, +1/2}`
Díky existenci spinu elektronu mohou mít dva elektrony v obalu vždy stejné hodnoty zbývajících kvantových čísel.
3.2. Elektronová konfigurace
Elektronovou konfigurací máme na mysli uspořádání elektronů v obalech atomů. Nejjednodušším atomem je atom vodíku, který obsahuje v obalu jen jeden elektron. Tento elektron je umístěný v orbitalu 1s. U ostatních atomů, vzhledem k většímu počtu elektronů, je uspořádání elektronů v obalu složitější a řídí se několika pravidly.
3.2.1. Pravidla pro zaplňování atomových orbitalů
-
Pauliho vylučovací princip
V obalu atomu neexistují žádné dva elektrony ve stejném kvantovém stavu. V praxi to znamená, že pokud dva elektrony můžeme popsat stejným hlavním, vedlejším i magnetickým kvantovým číslem, musí se lišit alespoň hodnotou spinu. -
Minimalizace energie
Elektrony zaplňují atomové orbitaly tak, aby měl atom v základním stavu co nejmenší energii. O energii rozhoduje hlavní kvantové číslo. Pomocí periodické tabulky můžeme lehko zjistit, v jakém pořadí se orbitaly zaplňují. -
Hundovo pravidlo
V degenerovaných orbitalech vznikají elektronové páry až poté, co byl zaplněn každý orbital jedním elektronem. Nespárované elektrony mají stejný spin.
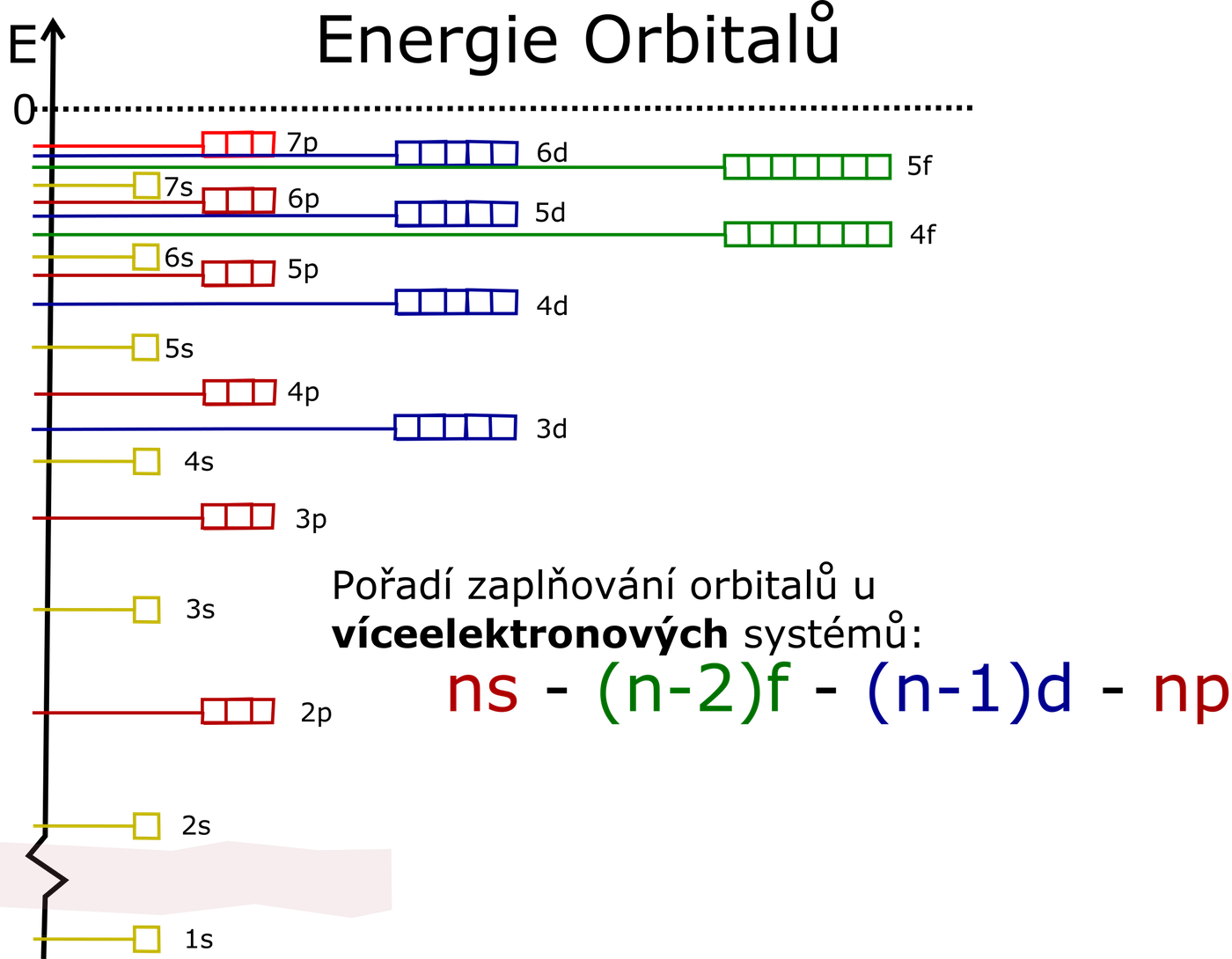
Obr. 27 – Energie orbitalů

Obr. 28 – zápis orbitalů
3.2.2. Zápis elektronové konfigurace
Elektronovou konfiguraci můžeme zapsat několika způsoby. Elektronovou konfiguraci železa můžeme zapsat:
-
Úplným zápisem orbitalů, ve kterých je umístěno všech 26 elektronů
`1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^6 `
Čísla v exponentu udávají počet elektronů v orbitalu umístěných. Všimněte si, že jejich součet je roven počtu elektronů v atomovém obalu železa.
Orbitaly můžeme rozdělit na vnitřní (leží blíže jádru) a vnější, nazývané valenční. Elektrony umístěné ve valenčních orbitalech se podílí na chemických i fyzikálních procesech (fotoefekt, vznik iontů, vznik chemické vazby).

-
Zkráceným zápisem
Místo řady vnitřních orbitalů zapíšeme předcházející vzácný plyn a poté již jen valenční orbitaly. -
Pomocí rámečků

Pomocí elektronové konfigurace lze zapisovat také:
- ionty (částice, které mají nedostatek nebo nadbytek elektronů v elektronovém obalu).
-
atomy v excitovaném stavu. Excitovaný stav je stav s vyšší energií než je základní stav atomu. Do excitovaného stavu se atom může dostat přijetím energie ve formě elektromagnetického záření (pohlcením fotonu). Elektrony jsou potom umístěny dál od jádra.
Na obrázku můžeme vidět C v základním stavu a C* v excitovaném stavu:
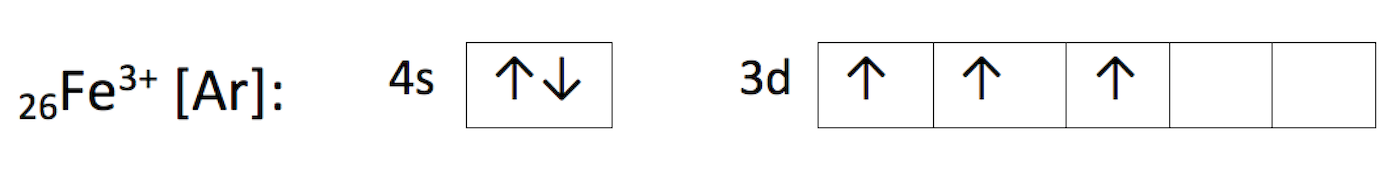
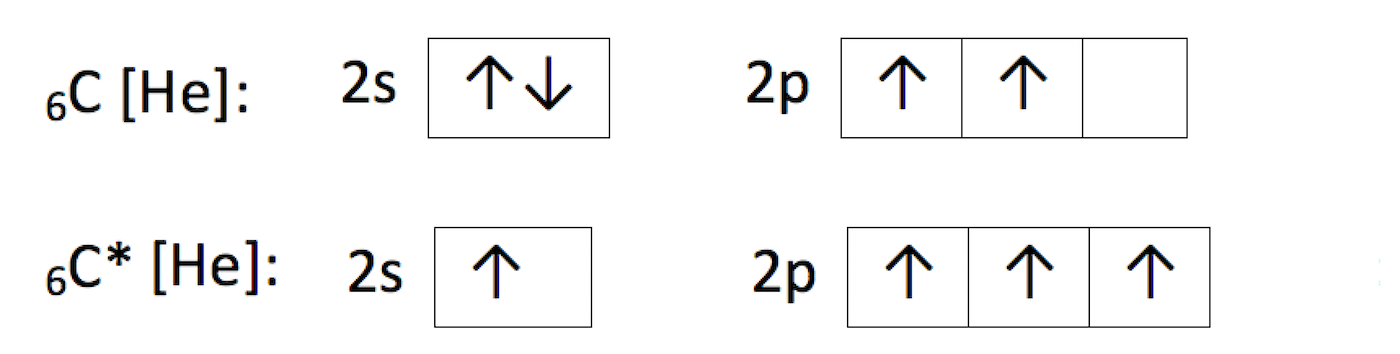
`_{26}Fe [Ar] : 4s^2 3d^6 `
3.3. Spektrum atomu vodíku
Poznatek, že energie atomů je kvantována a že může nabývat jen určitých dovolených hodnot, byl potvrzen řadou experimentů. Jeden z nich se týkal spekter záření vydávaného atomy při výbojích v plynech.
Spektrum záření vydávaného látkami se dělí podle dvou kritérií.
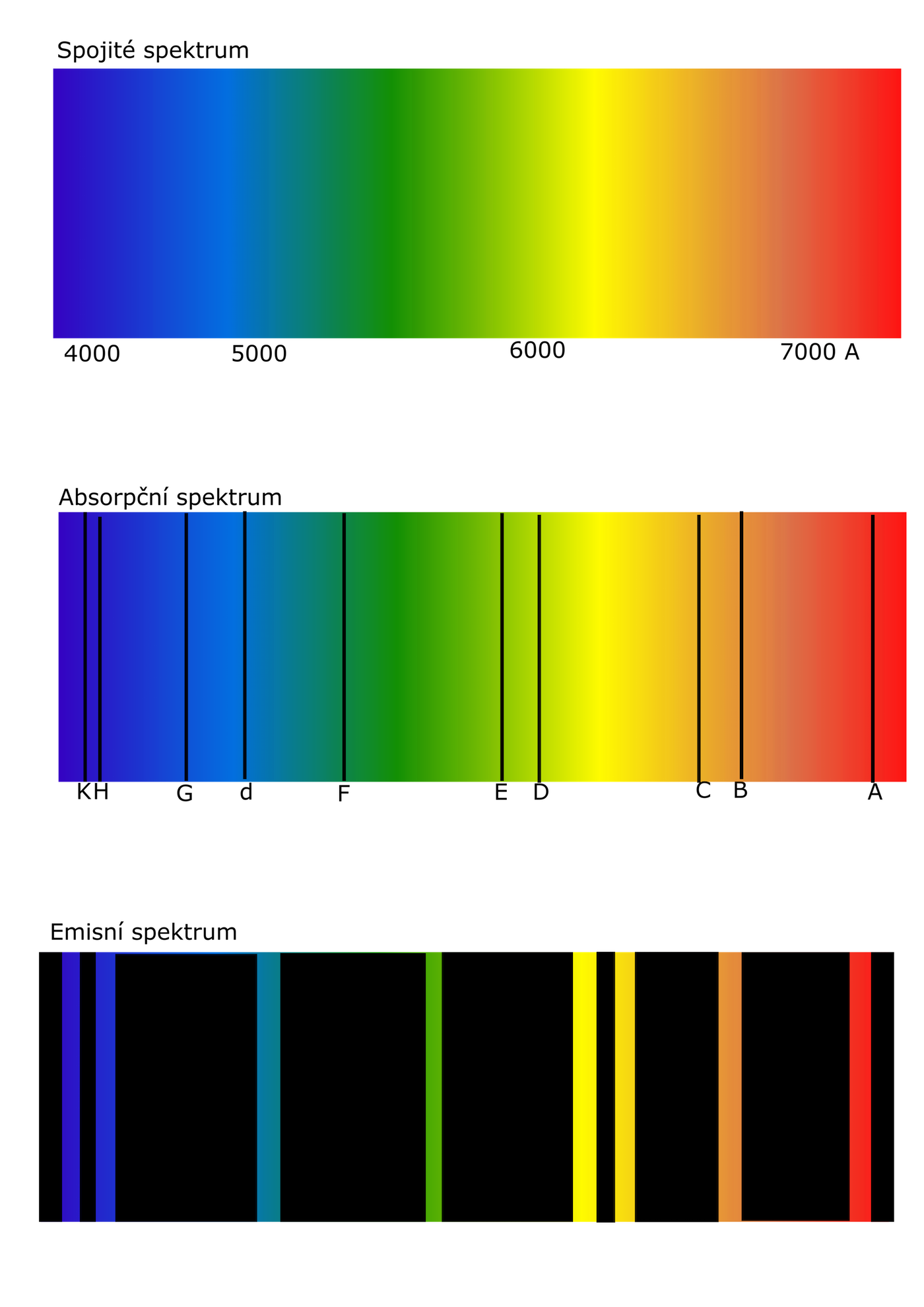
Obr. 29 – spektra atomů
Podle způsobu vzniku spektra ho dělíme na
- emisní – spektrum je emitováno tělesem
- absorpční – vzniká tehdy, když část spektra těleso pohltí a dál pozorujeme jen ty složky spektra, které pohlceny nebyly
Podle tvaru spektra ho dělíme na
- spojité – tvoří ho záření všech vlnových délek
- čárové – spektrum je tvořeno jen zářením o určitých vlnových délkách
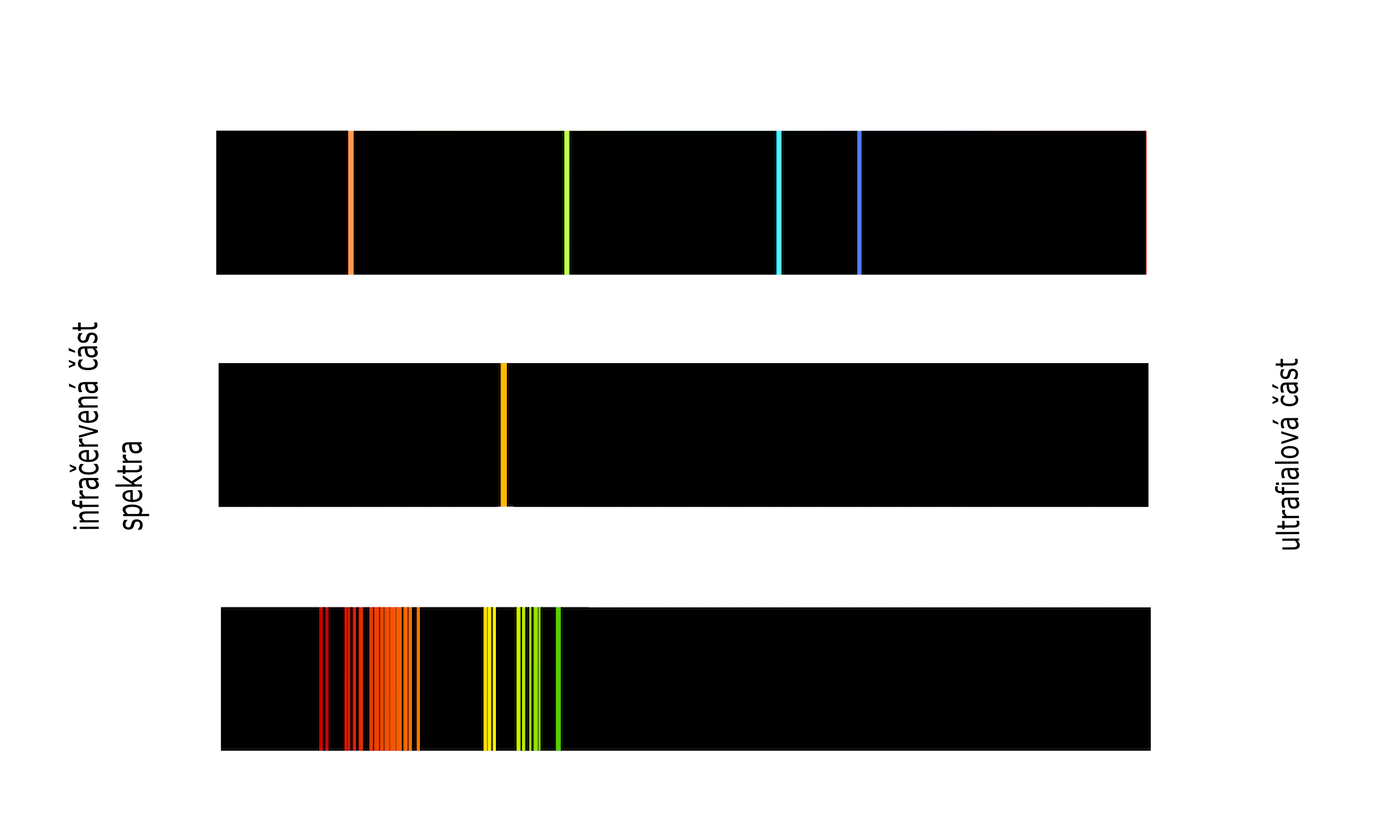
Obr. 30 – čárové spektrum
Soustava spektrálních čar je pro každý druh atomů, každý prvek charakteristická. Na základě znalosti spektra lze každý prvek přesně identifikovat a provádět tak chemickou spektrální analýzu. Tímto způsobem bylo objeveno helium dříve na Slunci než na Zemi.
Jako jedno z prvních bylo zkoumáno spektrum atomu vodíku.
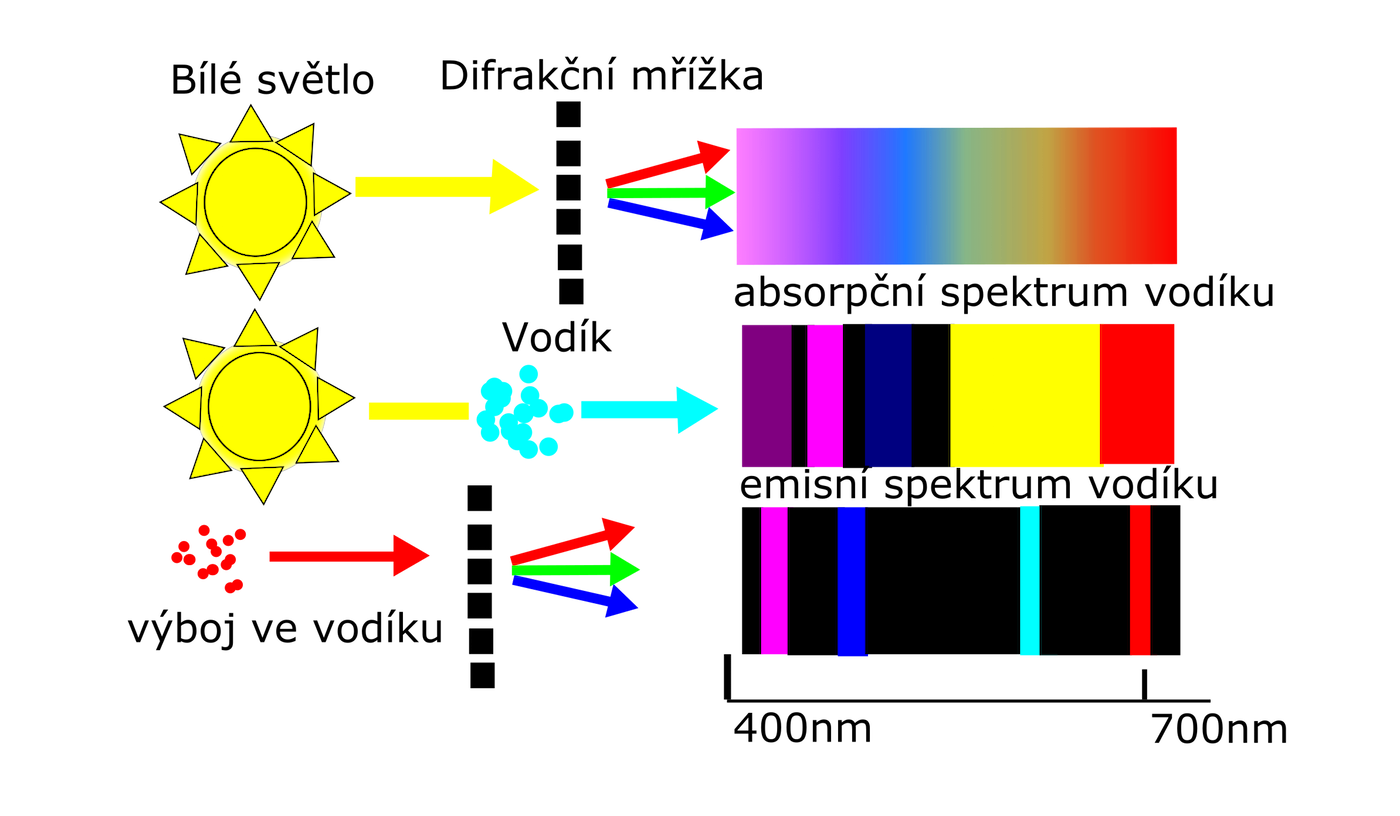
Obr. 31 – spektrum atomu vodíku
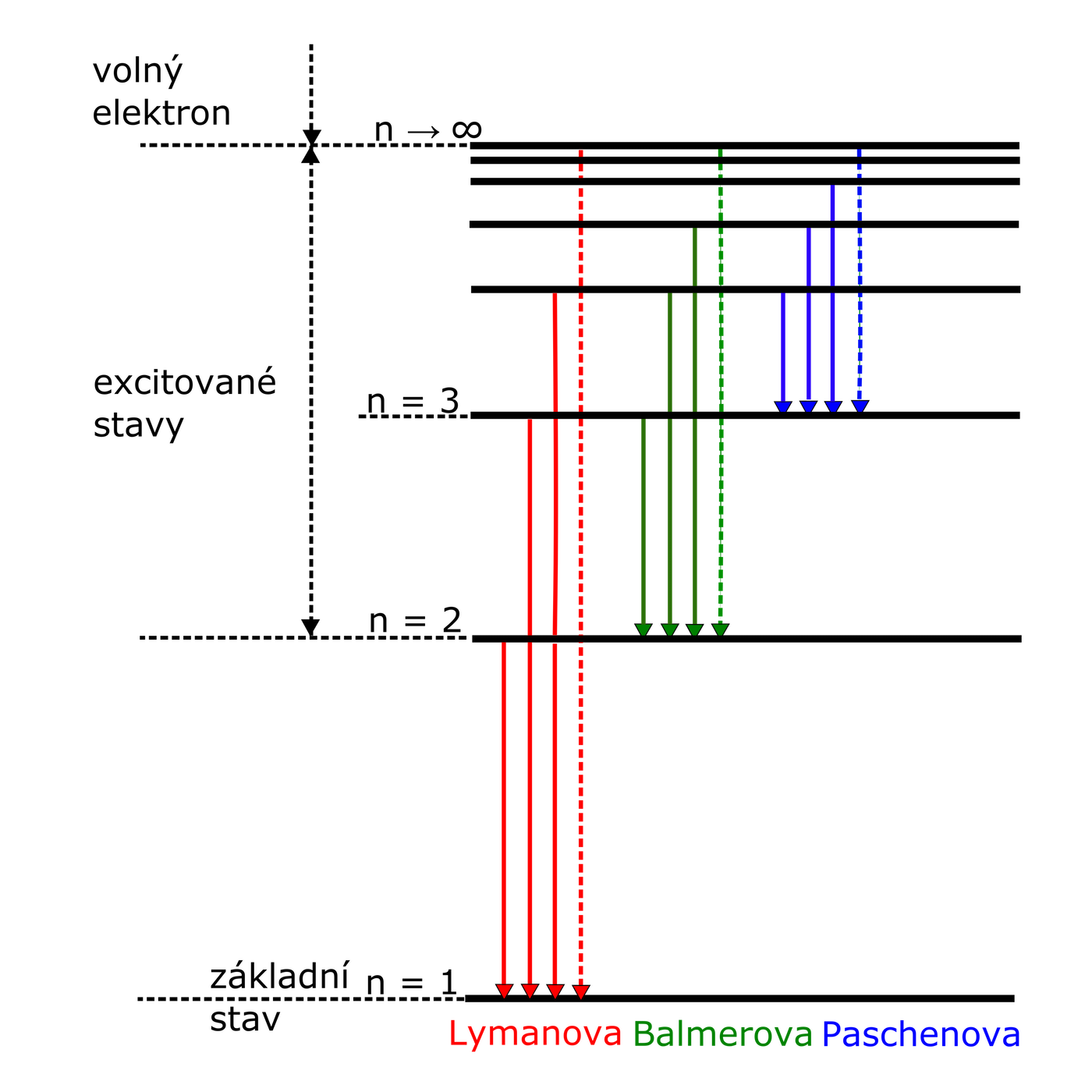
Vodík se může nacházet jen v určitých energetických stavech. Při přeskoku elektronu z vyššího (excitovaného) stavu do nižšího, vyzařuje atom vodíku elektromagnetické záření. Série spektrálních čar atomu vodíku se nazývají podle svých objevitelů.
Z obrázku č. 32 vidíme, že Lymanova série vzniká při přeskoku elektronu z vyšších energetických stavů do stavu s n=1.
Balmerova série vzniká při přeskoku elektronu z vyšších energetických stavů do stavu s n=2.
Paschenova série vzniká při přeskoku elektronu z vyšších energetických stavů do stavu s n=3.
Při přeskoku elektronu z vyšší energetické hladiny na nižší vyzáří atom vodíku foton, jehož energie je rovna
`h * f = E_{n'} - E_n `
Pro energetické hladiny platí
`E_n = - {h * R}/n^2 `
Bylo zjištěno, že pro atom vodíku má –h.R hodnotu -13,6 eV, což je také energie atomu vodíku v základním stavu.
Série spektrálních čar, které odpovídají přechodům z vyšších stavů do jistých zvolených nižších, se u atomu vodíku nazývají jmény. Například sérii, která odpovídá přechodům ze stavu s n>2 do stavu n=2, se říká Balmerova série.

- Určete energie a vlnové délky záření čar Balmerovy série, které odpovídají přechodům 3→2, 4→2.
- Z jaké části spektra jsou tyto čáry?
Úkol vypracujte do sešitů:
Zjistěte, do jaké oblasti spektra spadá Lymanova a Paschenova série spektrálních čar.
3.4. Atom vodíku
Atom vodíku je nejjednodušší atom, který se skládá z jednoho protonu v jádře a jednoho elektronu v obalu.
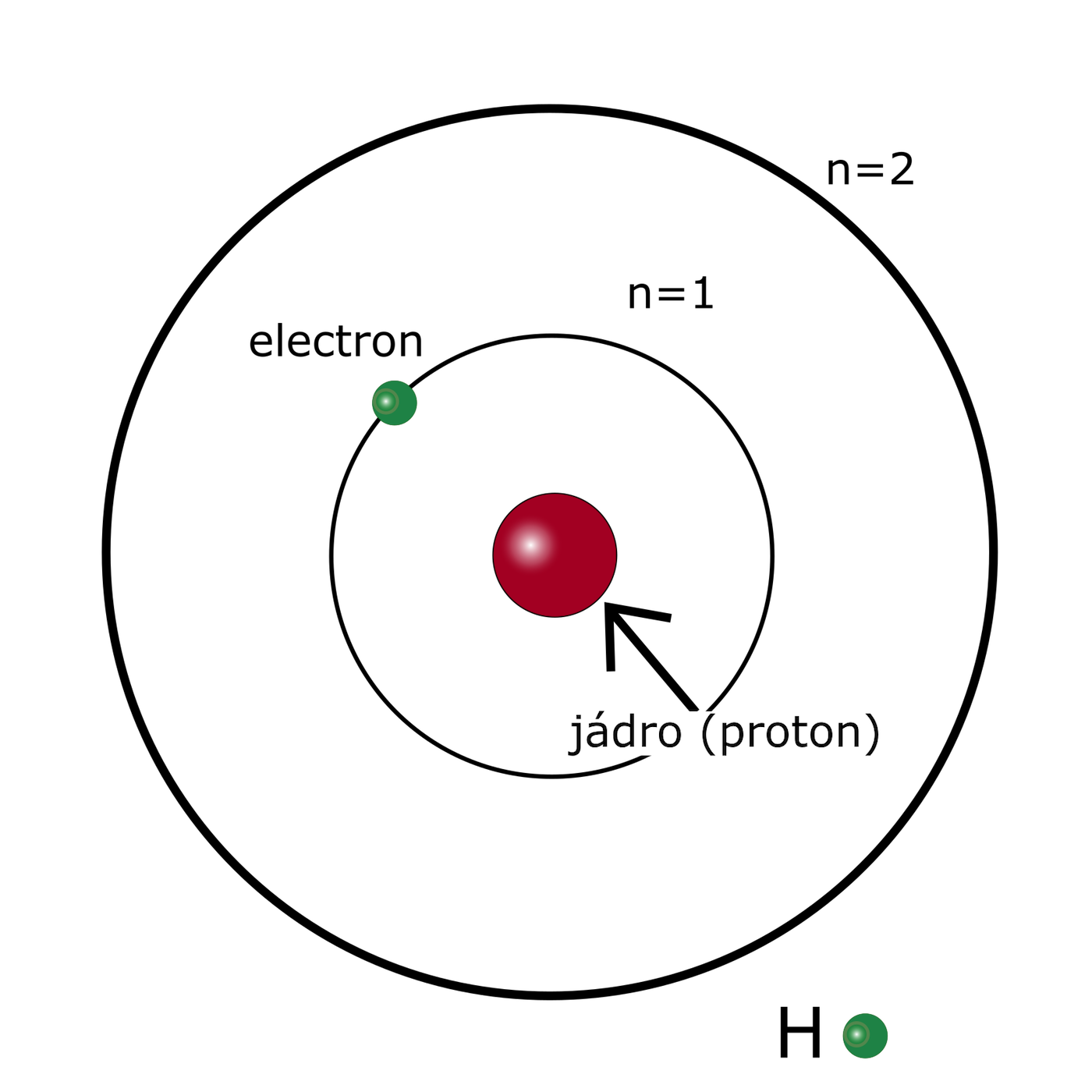
Obr. 33 – základní stav atomu vodíku
Na obrázku je atom vodíku v základním stavu. Elektron je obsazen v orbitalu 1s. V základním stavu má atom vodíku energii E1 = -13,6 eV. Je to nejnižší možná energie atomu vodíku.
Jestliže atomu dodáme energii ve formě elektromagnetického záření (atom pohltí foton), přejde atom do excitovaného stavu, elektron přeskočí na vyšší energetickou hladinu. Energii atomu v excitovaném stavu vypočítáme
`E_n = (E_1)/n^2 `
kde E1 je energie atomu vodíku v základním stavu a n je hlavní kvantové číslo.
Vypočítejte jakou energii má atom vodíku ve stavu s n=5.
Excitovaný stav je stav s vyšší hodnotou energie než základní stav.
Excitovaný stav není pro atom energeticky výhodný, a proto dochází k vyzáření fotonu a ke zpětnému přeskoku na nižší hladinu. Vyzářený foton má energii
`h * f = E_n - E_{n'} `
Celý děj ukazuje následující animace:
Dodáme-li atomu vodíku v základním stavu energii -13,6 eV, „rozbijeme ho“. Elektron již není poután k jádru a říkáme, že jsme ho ionizovali.
Ionizační energie Ei je energie potřebná k odtržení elektronu z elektronového obalu.
Obecně platí
`E_i = |E_n| `
Záměrně byly hodnoty energií atomu stanoveny jako záporné hodnoty. Nejmenší energii má atom v základním stavu a v excitovaných stavech je tato hodnota vyšší. Pro n→∞ je energie atomu rovna nule. V tomto stavu již není elektron poután k jádru.
Atom vodíku je ve stavu s n=8. Jakou energii mu musíme dodat, abychom ho ionizovali?
Jakou frekvenci by měl foton vyzářený při zpětném přechodu atomu do základního stavu?
Testové otázky
3.5. Lasery
Laser je zdroj světla mimořádných vlastností. Jeho název vznikl z prvních písmen anglického názvu, který vystihuje základní princip tohoto zařízení - Light Amplification by Stimulated Emission of Radiation, neboli zesilování světla stimulovanou emisí záření.


Obr. 34, 35 – laser
3.5.1. Absorpce a emise světla
Světlo vzniká při přechodu atomu z jednoho stavu do druhého. Existují tři možnosti jak toho docílit.
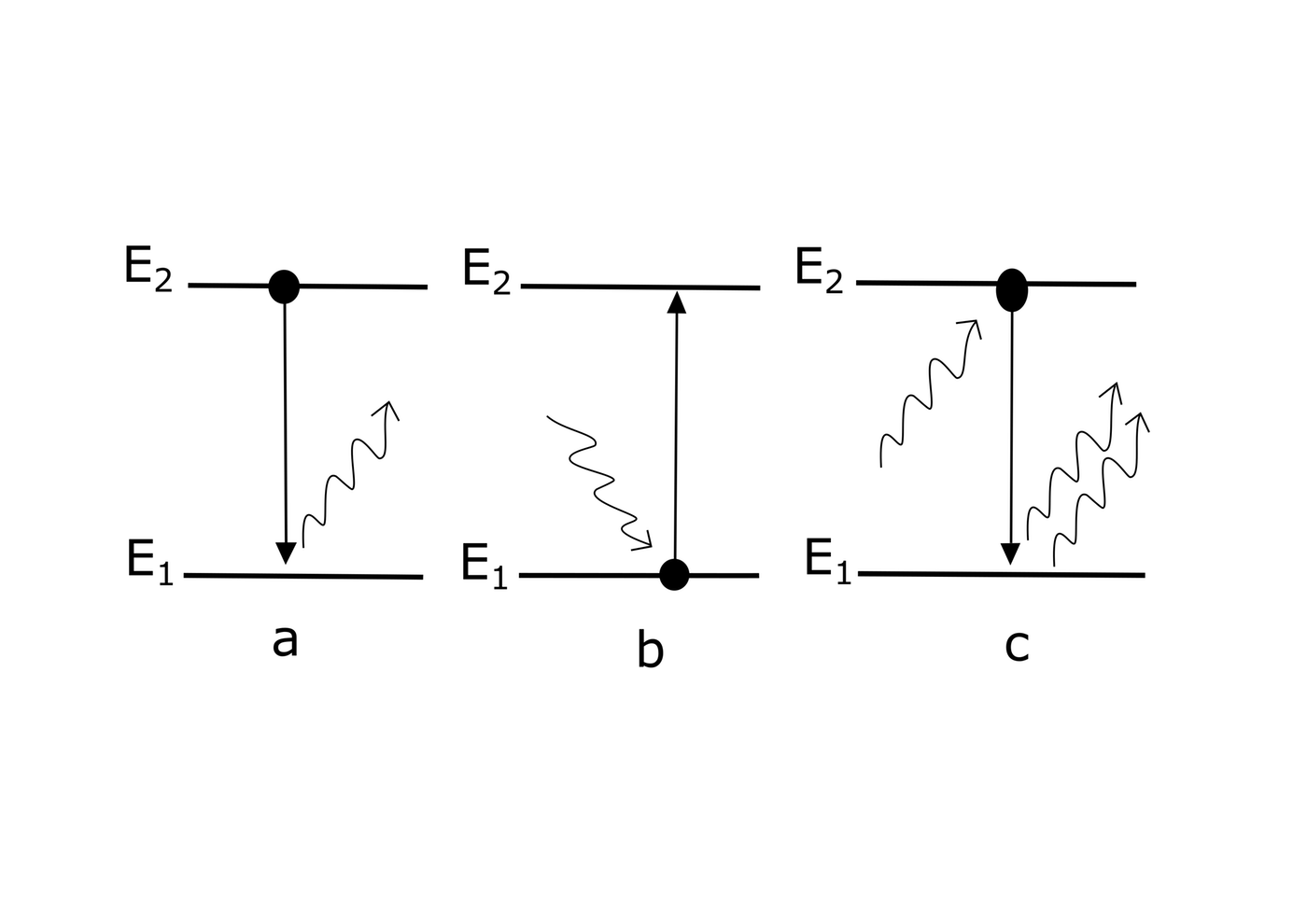
Obr. 36 – a) absorpce světla, b) spontánní emise , c) stimulovaná emise
-
Absorpce světla
(obr. 35b)
Na atom dopadne foton o energii h.f. Atom přejde ze stavu s nižší energií E1 do excitovaného stavu s vyšší energií E2.
-
Spontánní emise (obr.35a)
Atom v excitovaném stavu s energií E2 přejde do základního stavu s energií E1 a vyzáří přitom foton o energii h.f. - Stimulovaná emise (obr.35c) Na atom v excitovaném stavu dopadá foton o energii h.f a donutí ho přejít do základního stavu a přitom uvolnit další foton o stejné energii. Oba fotony se potom pohybují stejným směrem jako foton, který tuto emisi vyvolal. Oba fotony mají stejnou frekvenci a stejnou fázi, jedná se proto o koherentní záření. Proces se může opakovat s dalšími atomy a záření se tak zesiluje. Na obrázku č. 36 je vidět rozdíl mezi nekoherentním zářením žárovky a koherentním zářením laseru.
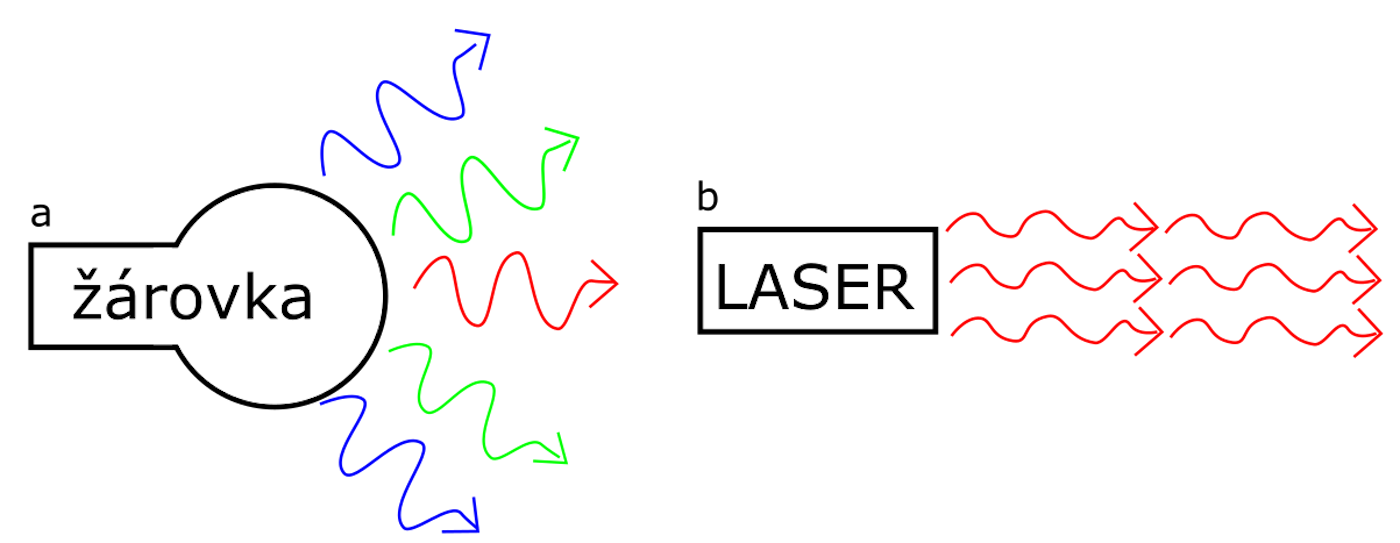
Obr. 37 – nekoherentní a koherentní záření
3.5.2. Princip laseru
Laserové světlo je světlo vyvolané stimulovanou emisí.
Podmínky sestrojení laseru:
Je nutné
- vytvořit nerovnovážný stav, kdy bude více atomů v látce na vyšších energetických hladinách než na nižších. Musíme tedy vytvořit tzv. aktivní prostředí.
- zajistit dostatek fotonů způsobujících stimulovanou emisi.
V praxi dostatek fotonů zajistíme tak, že aktivní látku umístíme mezi dvě rovnoběžná zrcadla, která většinu světla odrazí.
K zajištění větší obsazenosti excitované hladiny se používají různé metody, které závisí na typu laseru. Např. u helium-neonového laseru se využívá toho, že napětí mezi elektrodami způsobí proud elektronů, které excitují atomy helia a ty potom při srážkách s atomy neonu jim předávají část své energie a excitují je do vyšších energetických hladin. Excitované atomy neonu přechází stimulovanou emisí do základního stavu.
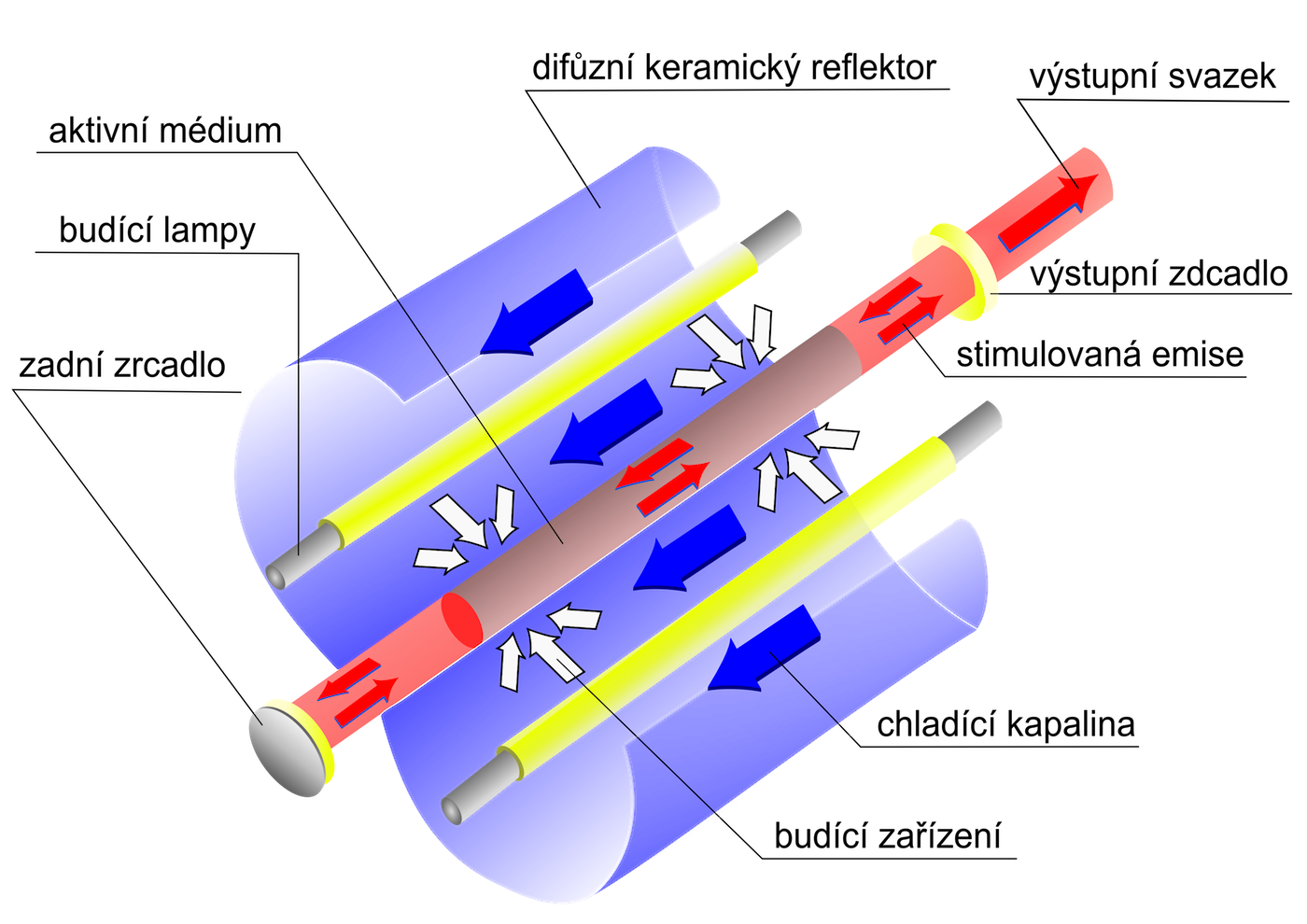
Obr. 38 – stavba laseru

Obr. 39 – helium-neonový laser
3.5.3. Vlastnosti laserového světla
Světlo z laserového zdroje má výjimečné vlastnosti. Je pro něj typická:
- vysoká koherence
- vysoká směrovost – laserový paprsek je rovnoběžný a málo rozbíhavý
- vysoká monochromatičnost – laser svítí na jediné frekvenci
- vysoká časová řiditelnost – můžeme zajistit, aby k vyzáření určitého množství energie došlo řádově v rozmezí pikosekund (vyzáření 1 J energie v takovém čase by poskytlo výkon 1 TW)
- vysoká zaostřitelnost – zvyšuje výkon paprsku
3.5.4. Využití laseru v praxi

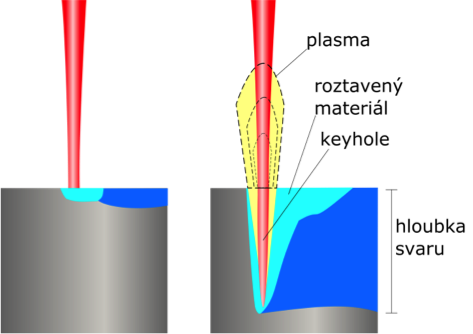
Obr. 40a – sváření laserem
Existují různé typy laserů lišících se aktivním prostředím i konstrukčním uspořádáním. Některé lasery pracují ve viditelné, jiné v infračervené nebo ultrafialové oblasti spektra. Různé typy laserů mají různé využití.
Při sváření a vrtání se uplatňují impulsní lasery, protože je nutné zvýšit výkon laseru.
Lasery se využívají v medicíně (laserový skalpel) i v technologické praxi. Ukládání informací pomocí laseru se uplatňuje v holografii. Ve vesmíru se lasery využívají jako nezávislý zdroj energie.
Obr. 41 – laserový skalpel