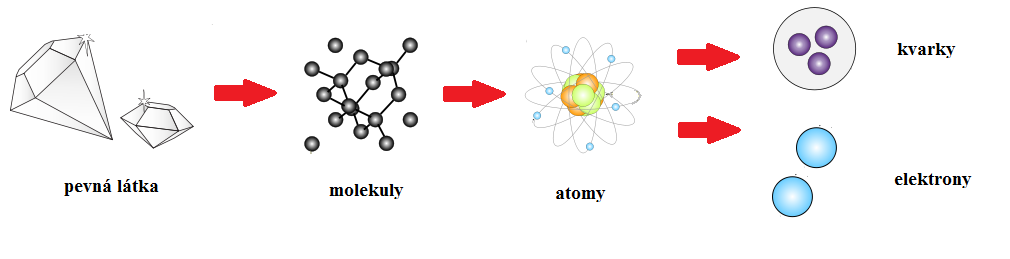
Molekulová fyzika se zabývá zkoumáním vlastností látek z pohledu jejich vnitřní struktury, pohybu částic a jejich vzájemného silového působení.
Z pohledu molekulové fyziky můžeme zahřívání vody a vzduchu ve sklenici popsat takto: Zvětšila se rychlost neuspořádaného pohybu částic vody a vzduchu, vzrostla vzdálenost mezi částicemi, dochází častěji k jejich vzájemným srážkám i ke srážkám částic se stěnami láhve.
Termodynamika je nauka o teple, která vysvětluje dynamické tepelné jevy (teplotní roztažnost, tepelná vodivost, skupenské přeměny) vhodnými veličinami a studuje závislosti mezi nimi. Při tom využívá zákona zachování a přeměny energie.
Historicky vznikla termodynamika z termiky, která se začala rozvíjet v 17. století. Jejím hlavním úkolem bylo měření teploty.
Položíme-li například sklenici s vodou v létě na přímé slunce, z makroskopického pohledu si všimneme, že vzrostla teplota vody a vzduchu ve sklenici, zvětšil se jejich objem a zmenšil tlak.
Kinetická teorie látek
Až do poloviny 19. století převládal ve světě názor, že teplo je druh spojité lehké kapaliny, kterou obsahují zahřátá tělesa a která přetéká z těles teplejších do chladnějších. Teprve ve druhé polovině 19. století, po letech experimentálních důkazů a sporů, u mnoha fyziků (Lomonosov, Clausius, Bernoulli, aj.) zvítězila myšlenka o vnitřním pohybu částic látky.
K pochopení podstaty tepelných jevů se proto musíme dívat na látku ne jako na celek, ale je zapotřebí ji vidět rozloženou na jednotlivé molekuly a atomy z kterých se všechny látky skládají. Veličiny teplota, teplo nebo tlak je třeba chápat podle představ o částicovém složení látek. Teorie, která přistupuje, ke zkoumání tepelných jevů z hlediska částicové stavby látek se nazývá kinetická teorie látek a tvoří základ molekulové a statistické fyziky.
Podle kinetické teorie látek platí:
-
Látky všech skupenství jsou složeny z částic.
Důkazem je například křemík, na který se díváme rastrovacím tunelovým mikroskopem. Uvidíme částice uspořádané do krystalické mřížky. Prostor, který těleso zabírá, ale není těmito částicemi beze zbytku vyplněn.
Mezi částicemi jsou velké mezery, látka má nespojitou (diskrétní) strukturu. -
Všechny částice (atomy, ionty, molekuly) se v látkách neustále a neuspořádaně pohybují (konají tzv. tepelný pohyb).
Pohyb částic v látkách je složen z posuvného, otáčivého a kmitavého pohybu. Neuspořádaný, neustálý pohyb částic v látce nazýváme tepelným pohybem. Důkazem je např. tlak plynu na stěny nádoby (nárazy volně se pohybujících částic na stěny nádoby), Brownův pohyb nebo difúze částic. -
Částice v látce na sebe navzájem působí silami, při malých vzdálenostech převládají přitažlivé a při velkých odpudivé síly.
Každá částice je přitahovaná jen nejbližšími částicemi ze svého okolí – ve sféře vzájemného silového působení. Důkazem existence přitažlivých sil je např. soudržnost pevných látek, o existenci odpudivých sil svědčí malá stlačitelnost kapalin.
Důsledky částicového složení látek
Brownův pohyb
Přímý důkaz správnosti kinetické energie poskytuje Brownův pohyb. Anglický botanik ROBERT BROWN (1773 – 1858) pozoroval v roce 1827 pod mikroskopem drobné výtrusy plavuní a zjistil, že přestože jsou samy o sobě nehybné, ve vodě se pohybovaly po nepravidelných drahách a vykonávaly neustálý, trhavý pohyb, který byl tím prudší, čím byla zrnka menší a čím vyšší byla teplota vody. Brown tenkrát tento pohyb nesprávně považoval za projev života, nevěděl, že se přesvědčil o existenci molekul. Tento rychlý pohyb, který byl způsobený pohybem molekul vody, zdůvodnil francouzský fyzik Perrin až na začátku 20. století a matematicky ho popsal Albert Einstein.
Příčinou Brownova pohybu jsou nepravidelné nárazy velkého počtu molekul vody na mnohem větší částečky.
Molekuly vody působí v každém okamžiku na částici výslednou tlakovou silou, která způsobí, že částice vykonává nepravidelné posuvné a otáčivé pohyby, neustále mění směr a velikost své rychlosti.
Difúze

Obr. 2: Difúze barev do vody
Jakékoliv pronikání pohybujících se částic jedné látky mezi částice druhé látky bez přispění vnější síly nazýváme difúzí.
Částice proniknou z jedné látky do druhé, protože vykonávají tepelný pohyb. Zvýší-li se teplota, budou se částice pohybovat rychleji.
S difúzí se můžeme setkat často v běžném životě:
- Když necháte v dílně otevřenou láhev s ředidlem, ředidlo postupně vyprchá, jeho částice proniknou mezi částice vzduchu a zaplní celý prostor dílny.
- Částice z čaje difundují mezi částice vody v hrnku.
- Nalijete-li nad roztok modré skalice vodu, budou těžší částice skalice pronikat mezi částice vody tak dlouho až se voda se skalicí dokonale promísí.
Osmóza
Osmóza je difúze kapalin přes polopropustnou překážku. Vznikne, když se mísí dvě kapaliny, které jsou oddělené propustnou blánou.
Pronikání obou kapalin blánou ale neprobíhá stejně rychle, vzniká zde osmotický tlak, který je úměrný koncentraci roztoku.
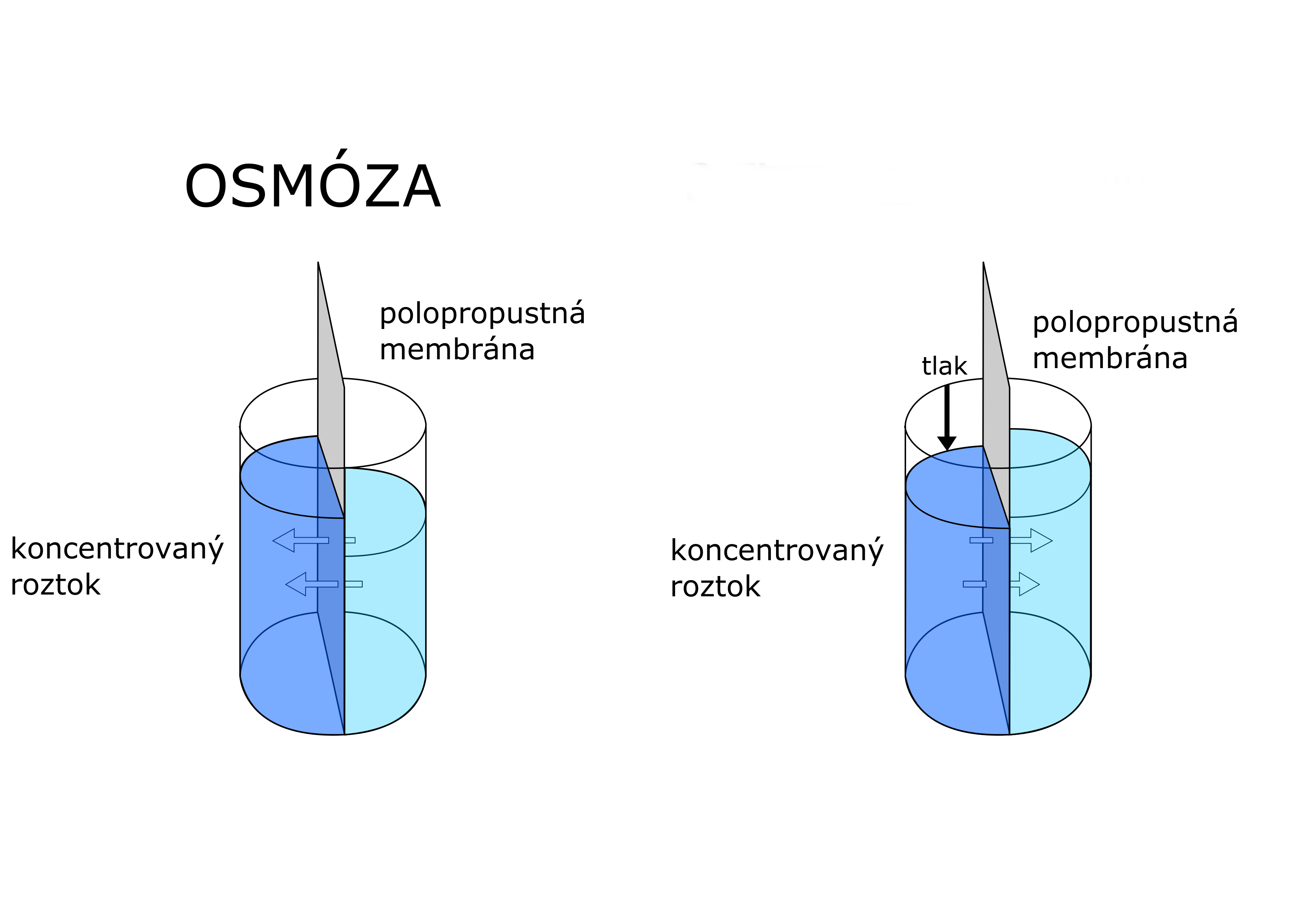
Obr. 3: Osmóza
Vazebná energie molekul
Rozmanitost látek kolem nás je důsledkem toho, že mezi jednotlivými atomy se mohou vytvářet vazby a tak vznikají složitější struktury – molekuly (dvouatomové, tříatomové nebo víceatomové). Celková energie těchto molekul je vždy menší než energie jednotlivých atomů, které molekuly tvoří. Tento rozdíl mezi energií jednotlivých izolovaných atomů a energií celé molekuly se nazývá vazebná energie. Je to energie, která byla v látce využita k vytvoření vazeb mezi částicemi. Díky ní jsou molekuly stabilní, nemohou se rozpadnout, až do chvíle kdy molekule vrátíme energii, o kterou při stavbě z atomů přišla.
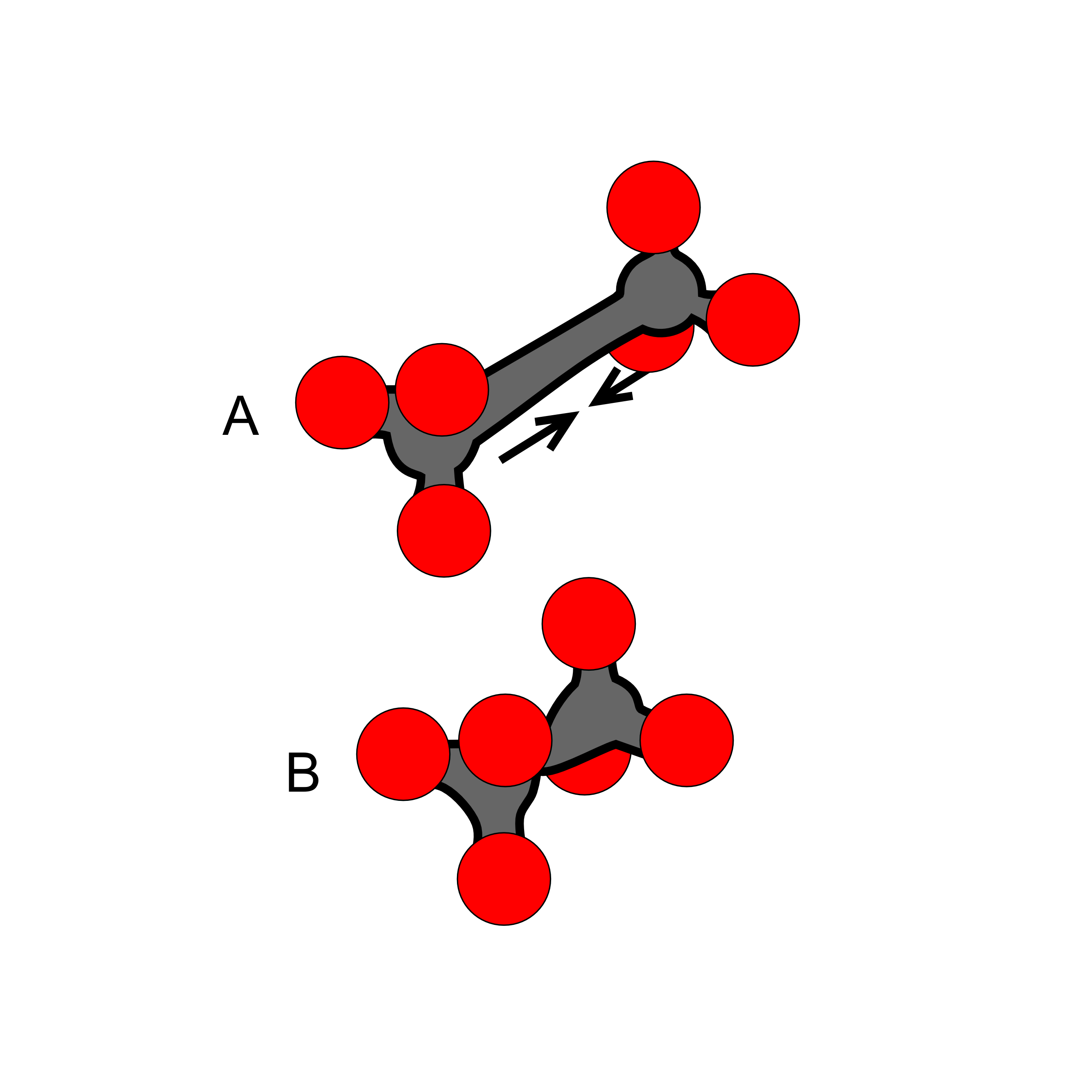
Obr. 4 Vazby mezi částicemi v látce
Vazebná energie je rovna práci, kterou je nutno vykonat abychom molekulu rozložili na jednotlivé atomy (abychom rozrušili vazby mezi částicemi).
Rozdělení látek podle skupenství
Pevné látky
V pevných látkách jsou atomy, molekuly nebo ionty uspořádány v malých vzdálenostech od sebe (střední vzdálenost mezi částicemi je 0,2 - 0,3 nm), jsou pevně vázány k sobě (převládají přitažlivé síly) a zabudovány do krystalické mřížky, která má přesné prostorové uspořádání. Jsou mezi sebou spojeny silnými přitažlivými silami, které způsobují, že těleso má určitý tvar a objem, jejich částice kmitají okolo svých rovnovážných poloh, ale nemohou svoji polohu změnit.
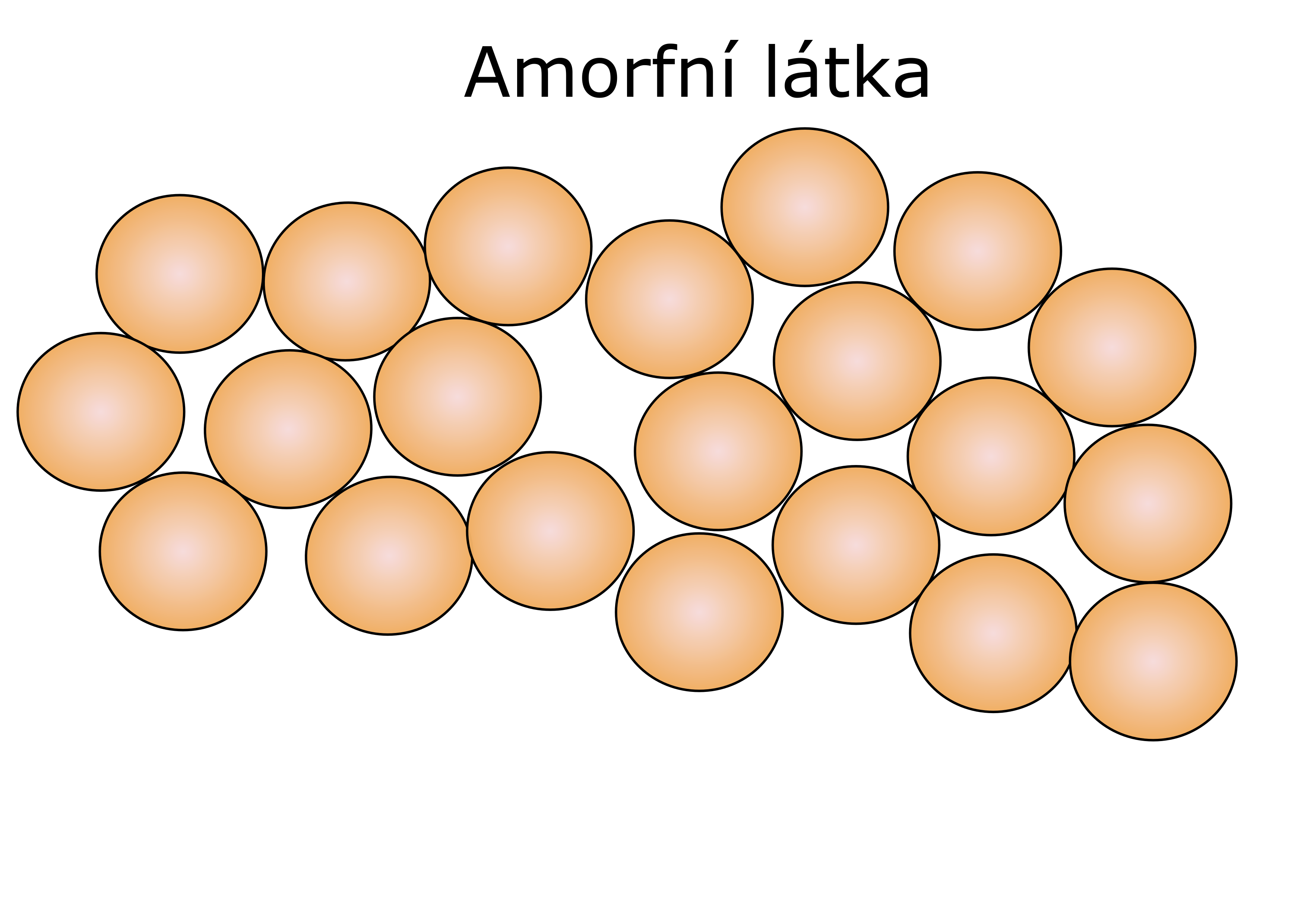
Proto mají pevné látky stále stejný tvar a objem, který mohou změnit jen působením velkých vnějších sil. Výjimku tvoří látky, které mají pružnost nebo elasticitu. Tyto látky nemají krystalickou strukturu, jsou proto beztvaré – amorfní.
V pevných látkách vykonává každý atom obrovské množství kmitů kolem své rovnovážné polohy. Jejich počet se nezmenší ani, když látku ochladíme až na nejnižší teplotu. Jenom rozkmity atomů (výkyvy) jsou menší než při obyčejné teplotě.
Celková vnitřní potenciální energie částic v pevných látkách je větší než celková vnitřní kinetická energie částic kmitajících kolem rovnovážných poloh.
P. Debye určil:
| Látka | Počet kmitů atomu v látce za sekundu |
| Olovo | 1,8 biliónů |
| Stříbro | 4,4 biliónů |
| Měď | 8,1 biliónů |
| Diamant | 38,7 biliónů |
Čím je látka tvrdší, tím pevnější vazby poutají atomy mezi sebou, tím je kmitání rychlejší.
Kapaliny
U kapalin je uspořádání podobné jako u amorfních látek. Částice se v látce nachází ve větších vzdálenostech od sebe než v pevných látkách.
Částice jsou navzájem drženy menšími přitažlivými silami, ale kmitají (asi bilionkrát za sekundu) kolem rovnovážných poloh silně, tak že je tyto síly již nedokáží udržet ve stálé vzdálenosti, v rovnovážné poloze vydrží vždy jen chvíli, ihned se přeuspořádají a najdou novou rovnovážnou polohu.
U kapalin proto existuje menší uspořádanost částic než v pevných látkách. Kapaliny jsou proto tekuté a mají stálý objem, který ale může zaplnit jakýkoliv tvar nádoby.
Plyny
Plyn je látka, která již nemá stálý tvar ani objem, a vyplní jakýkoliv prostor v nádobě, protože má částice rozmístěny ve velkých vzdálenostech od sebe, kdy lze zanedbat vzájemné přitažlivé síly. V plynech převládá tepelný pohyb. Částice se pohybují velkou rychlostí tak, že neustále mění svůj směr v důsledku srážek s jinými částicemi plynu nebo se stěnami nádoby.
Tyto nárazy způsobují tlak plynu. Každá molekula má jinou rychlost a proto také jinou pohybovou energii.
Kinetická teorie plynů byla ověřena mnoha pokusy. Je například dokázáno, že při normální teplotě (0 °C) a normálním atmosférickém tlaku (1013 hPa) je v litru kyslíku asi 3 . 1022 molekul, které se pohybují rychlostí okolo 430 m/s. Každá molekula má průměr asi 0,35 nm a průměrná vzdálenost mezi nimi je 7 nm. Mezi jednotlivými srážkami proběhne každá molekula tzv. střední volnou dráhu, která je dlouhá asi 90,5 nm.
Plazma
Dobře známé skupenství hmoty je plazma. Běžně se s ním ale v přírodě nesetkáme, vzniká jen při velmi vysokých teplotách, např. při výbojích blesku, jiskrovém výboji a ve vesmíru v nitru hvězd.
Jak plazma vznikne? Zahříváním plynu se zrychlí pohyb jeho atomů a molekul a srážky mezi nimi jsou prudší. Z obalů elektricky neutrálních atomů se tak vyrážejí elektrony, a z atomů se stávají kladně nabité ionty. Říkáme, že došlo k ionizaci plynu, vzniklo plazma, které už ale nemá vlastnosti plynu.
Ionizace plynu může pro některou látku nastávat již při teplotě 1000 °C, ale teprve při 100 000 °C jsou ionizovány všechny atomy. Takové plazma, ve kterém již neexistují elektricky neutrální částice, se nazývá úplně ionizované.

Obr. 9: Výtrysky plazmy na Slunci
Obr. 10: Plazmová koule
Obr. 11: Rozložení částic v plazmě
Testové otázky
Vysvětlete pomocí základních poznatků molekulové fyziky:
- šíření vůně parfému místností.
- vyluhování sáčku s čajem v horké vodě.
- zvyšování tlaku vzduchu v nádobě ohřevem nad zdrojem tepla.