Metabolismus
Jedním ze základních pojmů, který se váže k otázce bioenergetiky pohybové
činnosti, je
metabolismus. Tento termín lze jednoduše charakterizovat jako chemickou přeměnu látek
v organismu. Metabolismus můžeme rozdělit do dvou základních vzájemně opačně
fungujících chemických procesů, kterými jsou procesy
katabolické
a
anabolické
povahy.
Katabolické procesy lze charakterizovat v zásadě jako procesy rozkladné,
čili se jedná o procesy, kdy se z látek chemicky složitějších (např. z
glykogenu, triglyceridů, popřípadě z bílkovin) vznikají látky jednodušší.
Postupný rozklad složitějších látek bývá doprovázen ziskem
energie
ve formě dále využitelného
adenozintrifosfátu (ATP), který je jediným přímým zdrojem energie pro svalovou kontrakci. Kromě
zmíněného ATP se během rozkladných procesů uvolňuje také energie ve formě
tepla, které člověk využívá například k termoregulaci. Energii dále v organismu
využíváme pro
udržení tělesných funkcí, štěpení a využití potravy
a
neposlední řadě také k pohybové aktivitě.
Z charakteristiky
katabolických procesů je na první pohled zřejmé, že tyto budou v metabolismu
dominovat za situace zvýšené potřeby energie tedy například během pohybové
aktivity. Jak se dozvíte v dalších kapitolách, ani za klidových podmínek
nedochází k jejich kompletní inhibici.
Anabolické procesy považujeme za procesy syntetické (skladné), při kterých
z látek jednodušších vznikají látky složitější (zásobní). Během anabolických
dějů, na rozdíl od katabolických, se energie neprodukuje, ale naopak se
při nich energie spotřebovává. Anabolické pochody slouží například pro
obnovu živé hmoty
nebo
vytváření energetických zásob pro svalovou práci (například glykogenu). Převaha anabolických procesů
nad katabolickými je spojována s fází zotavení a jeho nejpřirozenější formou
– spánkem.
Energetické zdroje pro svalovou činnost
Lidský organismus disponuje dostatečně velkým energetickým potenciálem,
který má uschován ve formě zásobních látek převážně
tuků (lipidů).
Uvádí se, že průměrný dospělý muž o hmotnosti 70 kg má v tukových
buňkách (adipocytech) uskladněné množství energie odpovídající zhruba 112 000 kcal,
což představuje asi 80 % celkové zásoby energie v těle. Další zásobní formu
energie představuje
glykogen
(polysacharid), kterého má v těle dospělý jedinec zhruba mezi 300 až 500
gramy, a který poskytuje energii rovnající se asi 2 500 kcal. Glykogen
je v organismu uložen v játrech – hovoříme o něm jako o
glykogenu jaterním, a také ve svalech – ten nazýváme
glykogenem svalovým. Za hlavní funkci jaterního glykogenu se považuje udržování homeostatické
hladiny glukózy v krvi (tzv. euglykémie), protože glukóza představuje
jediný možný zdroj energie především pro mozek, ale také například pro
červené krvinky (erytrocyty), zatímco glykogen uložený ve svalech je primárně
určen jako zásoba energie pro svalovou činnost. Energii v sacharidech má
organismus uloženou ještě v podobě krevní
glukózy
(přibližně 20 g – 100 kcal). Samostatnou skupinu látek, ze kterých lze
čerpat energii pro svalovou činnost reprezentují
bílkoviny (proteiny).
V těchto stavebních kamenech živé hmoty je uloženo něco přes
25 000 kcal, ale energie pro svalovou činnost z proteinů, respektive přesněji
aminokyselin (základní stavební jednotka bílkovin), pochází pouze v omezené
míře a jen ve výjimečných případech jako například při dlouhotrvajícím
vytrvalostním či silovém výkonu. Ale v textu se metabolismu proteinů nebudeme
dále věnovat.
ATP jako zdroj energie pro svalovou činnost a způsoby jeho resyntézy
Organismus má k dispozici tři energetické cesty jak zabezpečit poptávku pracujících svalů po dostatečném množství energie ve formě ATP. Podíl metabolických procesů na tvorbě ATP determinuje především intenzita a trénovanost. Obrázek 1.1 demonstruje časovou souslednost příspěvku základních metabolických cest na produkci ATP. Organismus disponuje třemi způsoby tvorby ATP:
- Makroergní fosfáty (ATP + CP):alaktátová produkce ATP
- Anaerobní glykolýza: laktátová produkce ATP probíhající v cytoplazmě buňky a pocházející pouze ze štěpení sacharidů
- Oxidativní fosforylace: alaktátová produkce ATP odehrávající se v mitochondrii buňky; aerobně se štěpí sacharidy, lipidy a proteiny
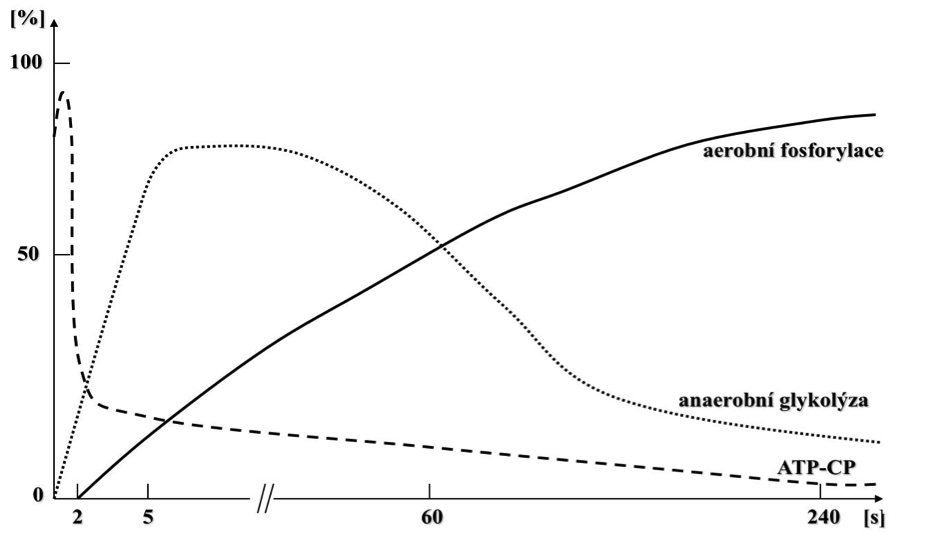
Obrázek 1.1 Zapojování energetických systémů a jejich přibližný podíl na produkci energie při jednorázové vysoce intenzivní práci
Makroergní fosfáty (ATP + CP)
ATP je ve svalu syntetizován přirozeně (adenin + D-ribóza + tři fosfátové vazby) a jako zdroj energie je za fyziologických podmínek nevyčerpatelný, protože při snížení koncentrace ATP v buňce primárně dochází k jeho okamžité obnově (resyntéze) prostřednictvím pohotovostní energie uschované v další sloučenině s makroergní vazbou nazývané kreatin fosfát (CP). Energie uložená v CP nemůže být pro svalovou činnost využita přímo. Podle nejnovějších studií vydrží ATP-CP systém jako zdroje energie pro svalovou kontrakci při maximální práci do 2 sekund, po kterých dochází ke snižování podílů makroergních fosfátů na hrazení energie pro svalovou činnost a hlavní roli na tvorbě ATP přebírá anaerobní glykolýza a aerobní fosforylace (spalování zejména sacharidů a lipidů). Degradaci ATP a jeho resyntézu pomocí CP ilustruje obrázek 1.2.

Obrázek 1.2 Rozklad ATP a obnova ATP pomocí kreatin fosfátu (CP)
Obecně lze říci, že při svalové kontrakci dochází k přeměně energie chemické (rozklad makroergních fosfátových vazeb ATP) na energii mechanickou, jejímž výsledkem je tělesný pohyb. Kromě toho dochází při svalové kontrakci ke vzniku tepla, jehož se při nadbytku (hypertermii) organismus zbavuje různými mechanismy jako například pocením.
Anaerobní (glykolytický) způsob resyntézy ATP
Výhradně se anaerobní produkce ATP uplatňuje za situace vysoké intenzity tělesné práce v době trvání do cca. 60 sekund, kde ještě není plně zajištěn dostatečný transport kyslíku do pracujících svalů. V organismu jsou glykolytické procesy aktivovány vyplavením adrenalinu, který zprostředkovaně aktivuje enzym glykogenfosforylázu, která zodpovídá za start štěpení glykogenu na jednotlivé molekuly glukózy (glykogen – polymer glukózy). Při porovnání rychlosti resyntézy ATP pomocí CP a anaerobními procesy, je anaerobní tvorba ATP výrazně pomalejší, protože je víceúrovňová, přičemž každou úroveň štěpení urychluje (katalyzuje) specifický enzym. Kulminace produkce ATP pomocí anaerobní glykogenolýzy za podmínek maximální práce se uvádí kolem 5. sekundy, kdy po několik dalších sekund je udržována její vysoká úroveň produkce, přičemž následně začíná klesat a ztrácet své dominantní postavení. Na rozdíl od aerobní fosforylace (oxidativního zisku ATP), anaerobní produkce ATP v buňce nevyžaduje přítomnost specializovaných buněčných organel (mitochondrií), protože ke štěpení sacharidů dochází v několika stupních přímo v cytoplazmě buňky. Anaerobní rozklad glykogenu (glykogenolýzy) popřípadě glukózy (glykolýzy) názorně demonstruje obrázek 1.3. Při anaerobním štěpení sacharidů vznikají z 1 molekuly glukózy 2 ATP, zatímco z 1 molekuly glykogenu (glukózy-1P) vznikají 3 molekuly ATP. Finálním produktem anaerobního štěpení sacharidů je tak vedle produkce ATP také laktát (sůl kyseliny mléčné), který vzniká z pyruvátu za přispění enzymu laktátdehydrogenázy. V dnešní době se většina autorů přiklání k názoru, že laktát není balastním produktem anaerobních procesů, nezpůsobuje pokles pH (acidózu), ale je významným zdrojem energie pro pracující svaly a myokard, ale pouze za aerobních podmínek. Laktát může být využit jako substrát pro zpětnou obnovu glykogenových zásob procesem nazývaným glukoneogeneze–tvorba jaterního glykogenu z nesacharidových zdrojů: aminokyselin, glycerolu nebo laktátu. Klíčovou roli při poklesu pH v pracujícím svalu sehrává zvýšená koncentrace H+. Na vznik H+ je více názorů. Jedna z teorií hovoří o vzniku primárně kyseliny mléčné, která disociuje na laktátový aniont (La–) a vodíkový kationt (H+). Jiná přisuzuje vznik H+ intenzivní hydrolýze ATP při svalové činnosti. Pokles pH sehrává významnou úlohu v rychlosti produkce ATP. Za klíčový enzym anaerobního metabolismu je považována fosfofruktokináza (PFK), která celou anaerobní tvorbu ATP reguluje. Enzym PFK je stimulován například poklesem koncentrace ATP v buňce nebo zvýšenou koncentrací jeho metabolitů (adenozindifosfátu a adenozinmonofosfátu). Na inhibici aktivity PFK se významnou měrou podílí právě zvýšená koncentrace H+, což vede ke vzniku únavy v důsledku nedostatečné tvorby ATP při intenzivním zatížení. S ohledem na relativně malé množství zásobního CP a omezenou dobu trvání anaerobního metabolismu při maximální práci je organismus odkázaný na produkci ATP aerobním způsobem, tedy za přístupu kyslíku.
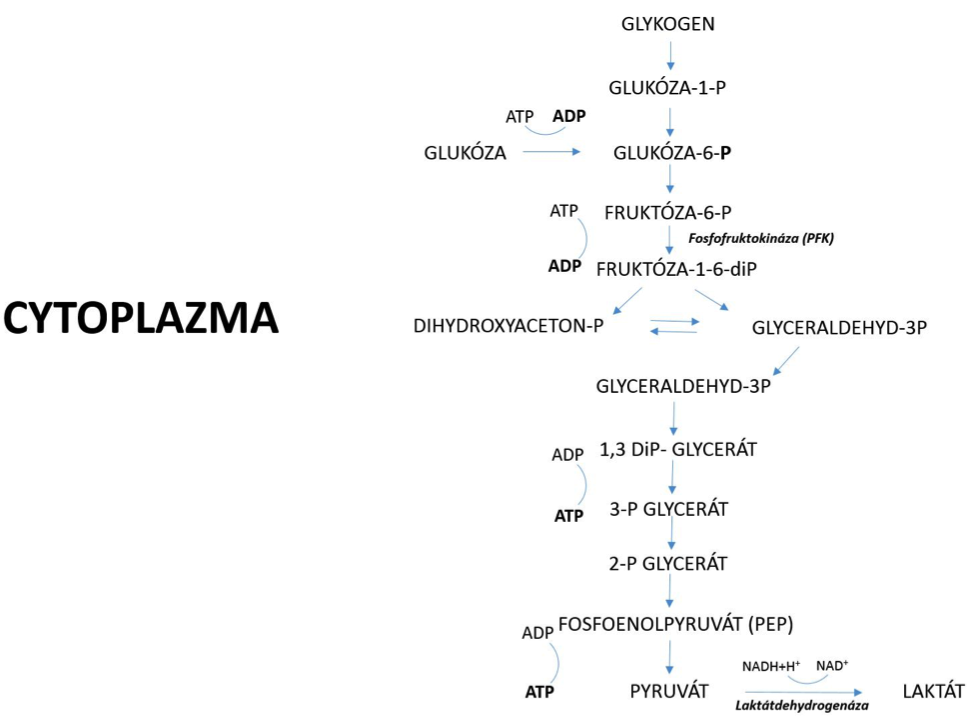
Obrázek 1.3 Anaerobní štěpení glykogenu a glukózy
Oxidativní fosforylace – aerobní způsob resyntézy ATP
Aerobní způsob produkce ATP představuje nejpomalejší, ale zato nejefektivnější
způsob zisku ATP, který se uplatňuje v klidu nebo při déletrvajících vytrvalostních
výkonech. Experimentálně bylo zjištěno, že aerobní podíl produkce energie
začíná převažovat nad anaerobním zhruba po 60 až 75 sekundách maximální
práce.
Zatímco anaerobně se ATP tvořilo v cytoplazmě, vznik ATP pomocí aerobní
fosforylace (za přístupu kyslíku) se odehrává v jedné z buněčných organel
–
mitochondrii. Aerobním způsobem lze metabolizovat sacharidy (glykogen + glukóza),
lipidy ve formě volných mastných kyselin (VMK) a ve výjimečných situacích
i proteiny, respektive aminokyseliny. Aby mohlo být při pohybové aktivitě
naplno využito aerobního metabolismu, je nezbytné pracujícímu svalu (svalové
buňce) poskytnout adekvátní množství kyslíku. V počáteční fázi zatížení
se pro aerobní procesy využívají omezené zásoby kyslíku rozpuštěného v
myoglobinu nebo hemoglobinu. Předpokladem plného rozvinutí oxidativních
procesů je zabezpečení dodávky adekvátního množství kyslíku do pracujících
svalů, což mají na starost
dýchací
a
kardiovaskulární
systém, které společně vytvářejí
transportní systém.
Základem aerobního metabolismu je Krebsův cyklus neboli cyklus kyseliny
citrónové, ve kterém se odehrávají oxido-redukční děje. V důsledku činnosti
enzymů
dehydrogenáz
dochází k oxidaci meziproduktů Krebsova cyklu (obrázek 1.4) a odštěpený
H+ je transportován pomocí
koenzymů
(v tomto případě vodíkových přenašečů)
nikotinamidadenindinukleotid (NAD) a flavinadenindinukleotid (FAD) do dýchacího (respiračního nebo také flavoprotein-cytochromového)
řetězce, kde dochází k syntéze ADP a volného fosforu (Pi) za vzniku ATP. V dýchacím
řetězci pak za přispění složitého systému biochemických procesů katalyzovaných
enzymy dochází ke slučování molekuly H+ s molekulou O2 za
vzniku tzv.
metabolické vody. Čili zjednodušeně řečeno, primárním úkolem kyslíku je oxidace H+
v mitochondrii
za vzniku vody. Během aerobního metabolismu sacharidů a lipidů dojde k jejich
kompletní oxidaci za vzniku H2O, oxidu uhličitého (CO2) a odlišného množství
ENERGIE ve formě ATP. CO2
jako odpadní látka aerobních procesů
vzniká v důsledku činnosti enzymů
dekarboxyláz, které se nacházejí v Krebsově cyklu. Spojení procesů terminálního oxidačního
řetězce a obnovy ATP se označuje za aerobní fosforylaci. Z obrázku 4 vyplývá,
že společným meziprodukcem při štěpení sacharidů a tuků vstupujícím do
Krebsova cyklu je sloučenina s názvem
acetyl-CoA.
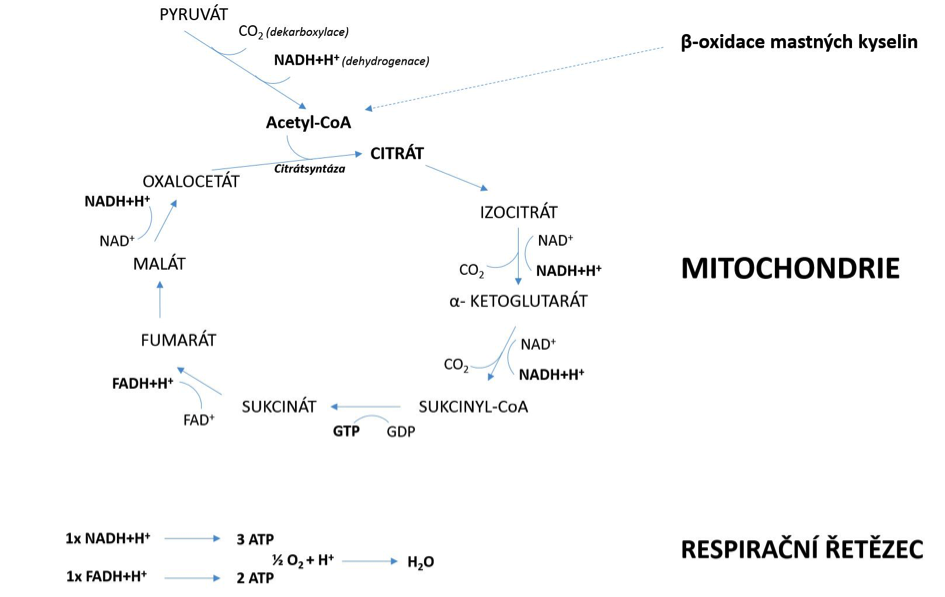
Obrázek 1.4 Krebsův cyklus
Za přítomnosti kyslíku probíhá štěpení sacharidů stejně jako u anaerobní glykolýzy, ale pouze na úroveň pyruvátu, který není redukován na laktát, ale v důsledku odloučení vodíku (dehydrogenací) a CO2 (dekarboxylací) se z pyruvátu (obsahuje 3 uhlíky) vytvoří acetyl-CoA (obsahuje 2 uhlíky), jakožto základní substrát vstupující do Krebsova cyklu. V případě rozkladu 1 mol glukózy je celkový energetický zisk 38 ATP (2 ATP anaerobně + 36 aerobně); zatímco u rozštěpení glykogenu se zisk rovná 39 ATP (3 ATP anaerobně + 36 aerobně). Z pohledu výnosu ATP je aerobní štěpení glykogenu 13x efektivnější než při jeho rozkladu anaerobní cestou, která z tohoto pohledu může být považována za způsob poměrně rychlý, nicméně značně nehospodárný.
Aerobní štěpení lipidů
Základní podmínkou pro využití tuků jako energetického substrátu pro vznik ATP je dostatečný přísun kyslíku, protože lipidy na rozdíl od sacharidů, lze štěpit pouze za přístupu kyslíku. Klíčovým faktorem pro využití lipidů při tělesné práci je intenzita zatížení. Uvádí se, že u běžné populace je nejvyšší metabolický obrat tuku asi po 15 až 20 minutách tělesné práce při intenzitě na úrovni aerobního prahu (50–60 % VO2max). Hlavním smyslem rozkladu tuků při tělesné práci je šetření relativně omezených sacharidových zdrojů a případně oddálení vzniku únavy či hypoglykémie (koncentrace glukózy v krvi < 3,3 mmol/l).
Tuky neboli triglyceridy (TG) se skládají z glycerolu a tří (volných)
mastných kyselin (VMK), které mohou mít povahu
nasycených (bez dvojné vazby mezi uhlíky – např. kyselina palmitová, stearová) nebo
nenasycených
MK (mezi uhlíky se nachází jedna nebo více dvojných vazeb – např. kyselina
linolenová neboli tzv. omega 3 MK). TG jsou v lidském organismu uloženy
v tukových buňkách (adipocytech). Podobně jako u sacharidů, také rozklad lipidů zahajuje
vyplavení adrenalinu, který v tomto případě stimuluje aktivitu enzymu
senzitivní lipázy. Mobilizace tukových zásob se děje zejména při tělesné práci, hladovění
nebo v chladu. Rozklad TG v cytoplazmě adipocytů je urychlován (katalyzován)
již zmíněnou
lipázou
za vzniku 1 glycerolu a 3 volných mastných kyselin (VMK), které opouštějí
adipocyt do krve. Protože jsou VMK nerozpustné ve vodě, musí se v krvi
navázat na bílkovinný transportér (albumin).
Aby mohlo dojít k využití energie svalovou buňkou pocházející
z VMK, musí se VMK dopravit z cytoplazmy buňky (difuze) až do mitochondrie,
kde teprve dochází k tvorbě ATP v procesu nazývaném
β-oxidací. Nicméně, membrána mitochondrie je pro VMK nepropustná. Proto se v cytoplazmě
VMK musí spojit s CoA a vzniká sloučenina
acyl-CoA MK, která se spojí s karnitinem, který
ji zjednodušeně řečeno transportuje přes membránu mitochondrie do vnitřního
prostoru (matrix) mitochondrie. Zde je nutné podotknout, že přítomnost
karnitinu je pro mitochondriální obrat MK zcela klíčovou. Bez karnitinu
nelze VMK v mitochondrii metabolizovat. L-karnitin je také módním doplňkem
stravy sportovců, ale jeho pozitivní účinky na obrat MK jsou často zpochybňovány.
Transport VMK do matrix mitochondrie je katalyzován pomocí enzymu
acylkarnitintransferázy. Po vstupu
acyl-CoA VMKdo mitochondrie nastává cyklická reakce (β-oxidace), kdy při každé otočce
dochází k dehydrogenaci
acyl-CoA VMK a vzniku finálního produktu acetyl-CoA, který se uplatňuje
jako energeticky bohatá sloučenina a vstupuje do Krebsova cyklu. Počet
cyklů
acyl-CoA VMK
závisí na počtu uhlíků příslušné VMK. Například u kyseliny stearové, která
má 18 C, je to 8 cyklů [(18:2)-1], protože v posledním osmém cyklu zůstanou
ze 4uhlíkatého
acyl-CoA VMK
přímo dva
acetyl-CoA (obrázek 1.5). Energetický zisk z β-oxidace kyseliny stearové je 146 ATP.
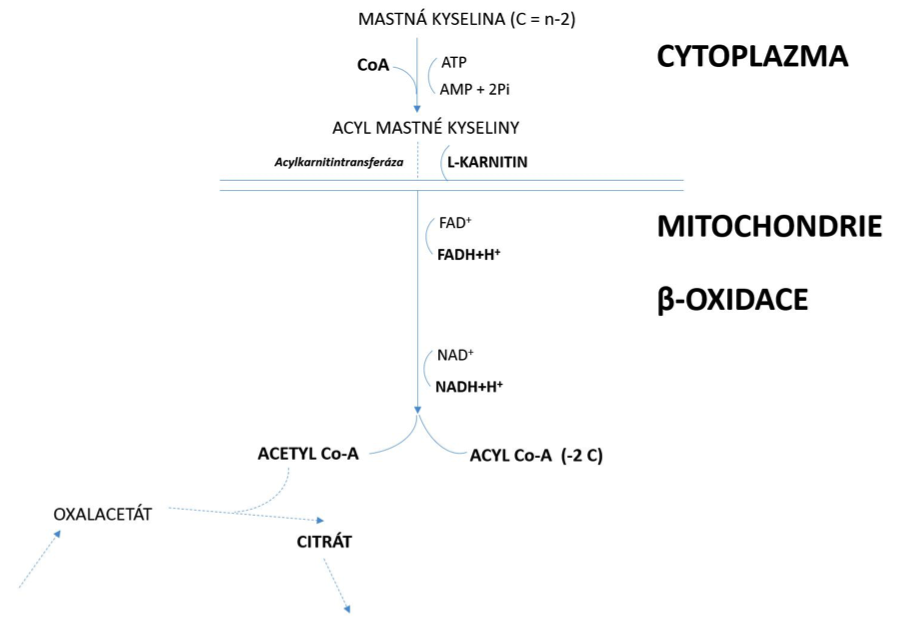
Obrázek 1.5 Schématické znázornění β-oxidace mastných kyselin
Časová souslednost zapojení energetických systémů při resyntéze ATP
Za podmínek maximální práce dochází ihned po začátku zatížení ke štěpení ATP a jeho rychlé resyntéze pomocí CP a rozvoji glykolýzy, přičemž její intenzita kulminuje okolo 5. sekundy. Zhruba po dalších 10 až 15 sekundách si udržuje anaerobní glykolýza vysoký podíl na tvorbě ATP, ale s časem se její význam snižuje. Při pokračujícím maximálním výkonu trvajícím déle než 60 až 75 sekund (běh na 800 m, plavání na 200 m) přebírá dominantní postavení v produkci ATP aerobní fosforylace Při nižších intenzitách zatížení je nástup dominance aerobního metabolismu při resyntéze ATP o to rychlejší.
Kontrolní otázky
- Kdy v organismu dominují katabolické procesy?
- Která látka slouží jako přímý zdroj energie svalovou kontrakci?
- Co je to laktát a při jakých procesech vzniká?
- Kde vzniká ATP při aerobní fosforylaci?
- Kolik molekul ATP se vytvoří při štěpení glykogenu při glykolýze a kolik při oxidativní fosforylaci?
- Co je zapotřebí pro získání energie z tuků, respektive volných mastných kyselin?
Literatura
Åstrand, P.-O., Rodahl, K., Dahl, H., & Strømme, S. B. (2003). Textbook of work physiology: Physiological bases of exercises (4th ed.). Champaign, IL: Human Kinetics.
Brooks, G. A., Fahey, T. D., & White, T. P. Baldwin, K. M. (2000). Exercise physiology: Human bioenergetics and its applications (3rd ed.). New York, NY: McGraw-Hill Companies.
Ganong, W. F., Herget, J., Blažek, T., & Herget, J. (1995). Přehled lékařské fyziologie. Jinočany: H&H.
Gastin, J. P. (2007). Quantification of anaerobic capacity. Scandinavian Journal of Medicine and Science in Sports, 4(2), 91–112.
Hamar, D., & Lipková, J. (2001). Fyziológia telesných cvičení. Bratislava: Univerzita Komenského.
Máček, M., & Radvanský, J. (2011). Fyziologie a klinické aspekty pohybové aktivity. Praha: Galén.
Rokyta, R. et al. (2000). Fyziologie. Praha: ISV.
Stejskal, P. (2007). Konec tradičního pojetí energetických zón? In K. Hůlka & F. Neuls (Eds.), Sborník referátu z 6. mezinárodního vědeckého semináře Efekty pohybového zatížení v edukačním prostředí tělesné výchovy a sportu (pp. 9–10). Olomouc: Univerzita Palackého.
Trojan, S. (2003). Lékařská fyziologie. Praha: Grada Publishing.